Додекаэдран
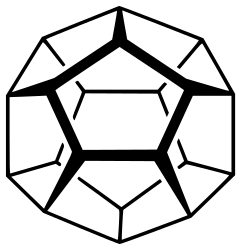
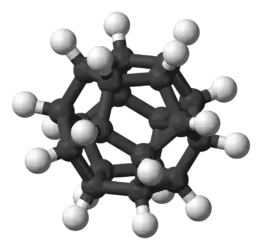
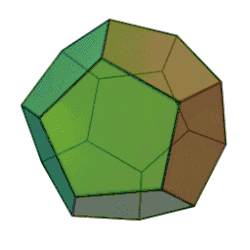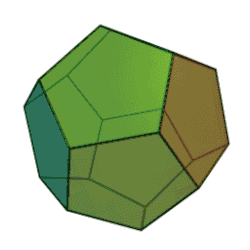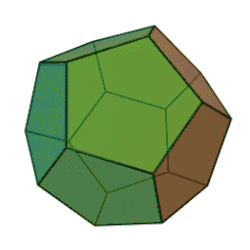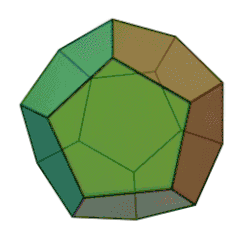
Додекаэдран представляет собой химическое соединение (C20H20), впервые синтезированное Лео Паке из Университета штата Огайо в 1982 году. В нём водород присоединен к додекаэдрическому каркасу из углерода. Это самый простой углеводород с полной икосаэдрической симметрией.
| Додекаэдран | |
|---|---|
   | |
| Общие | |
| Хим. формула | C20H20 |
| Физические свойства | |
| Состояние | твёрдое |
| Молярная масса | 260,378 г/моль |
| Плотность | 1,434 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 430 °C |
| Классификация | |
| Рег. номер CAS | 4493-23-6 |
| PubChem | 123218 |
| SMILES | |
| InChI | |
| ChEBI | 33013 |
| ChemSpider | 109833 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
В молекуле каждая вершина представляет собой атом углерода, который связывается с тремя соседними атомами углерода. Угол 108 ° каждого регулярного пятиугольника близок к идеальному углу соединения 109,5 ° для sp3 гибридизованного атома. Каждый атом углерода также связан с атомом водорода. Молекула, как и фуллерен, имеет Ih-симметрию, о чем свидетельствует ее протон-ЯМР-спектр, в котором все атомы водорода появляются при одном химическом сдвиге 3,38 м.д. Додекаэдран является одним из платоновых углеводородов наряду с кубаном и тетраэдраном, и не встречается в природе.
История
На протяжении более 30 лет несколько исследовательских групп активно занимались полным синтезом додекаэдра. В обзорной статье, опубликованной в 1978 году, описаны различные стратегии, существовавшие до этого времени.[1] Первая попытка была начата в 1964 г. Р.Б. Вудвордом с синтеза соединения трихинацена, который, как считалось, мог просто димеризоваться в додекаэдр. В гонке также участвовали другие группы, например, Филиппа Итона и Поля фон Рагуэ Шлейера.
Группа Лео Пакетта в Университете штата Огайо первой добилась успеха благодаря сложному маршруту из 29 шагов, который в основном строит додекаэдральный скелет по одному кольцу за раз, и, наконец, закрывает последнюю дыру.[2]
В 1987 году группа Хорста Принцбаха нашла более универсальный альтернативный путь синтеза.[3][4] Шлейер придерживался аналогичного подхода в своем синтезе адамантана.
Следуя этой идее, совместные усилия команды Принцбаха и группы Шлейера увенчались успехом, но в лучшем случае получили только 8% доходности за конверсию. В последующее десятилетие группа значительно оптимизировала этот путь, чтобы додекаэдр можно было получать в мультиграммовых количествах. Новый маршрут также облегчил получение производных с выбранными заменами и ненасыщенными углерод-углеродными связями. Двумя существенными событиями были открытие σ-бисомароароматичности[5] и образование фуллерена из высокобромированных видов додекаэдрана.
Примечания
- Philip E. Eaton. Towards dodecahedrane (англ.) // Tetrahedron. — 1979-01. — Vol. 35, iss. 19. — P. 2189–2223. — doi:10.1016/0040-4020(79)80114-3.
- Robert J. Ternansky, Douglas W. Balogh, Leo A. Paquette. Dodecahedrane (англ.) // Journal of the American Chemical Society. — 1982-08. — Vol. 104, iss. 16. — P. 4503–4504. — ISSN 0002-7863. — doi:10.1021/ja00380a040.
- Wolf-Dieter Fessner, Bulusu A. R. C. Murty, Horst Prinzbach. The Pagodane Route to Dodecahedranes—Thermal, Reductive, and Oxidative Transformations of Pagodanes (англ.) // Angewandte Chemie International Edition in English. — 1987-05. — Vol. 26, iss. 5. — P. 451–452. — ISSN 1521-3773 0570-0833, 1521-3773. — doi:10.1002/anie.198704511.
- Wolf-Dieter Fessner, Bulusu A. R. C. Murty, Jürgen Wörth, Dieter Hunkler, Hans Fritz. Dodecahedranes from[1.1.1.1Pagodanes] (англ.) // Angewandte Chemie International Edition in English. — 1987-05. — Vol. 26, iss. 5. — P. 452–454. — ISSN 1521-3773 0570-0833, 1521-3773. — doi:10.1002/anie.198704521.
- G. K. Surya. Prakash, V. V. Krishnamurthy, Rainer. Herges, Robert. Bau, Hanna. Yuan. Stable carbocations. 273. [1.1.1.1- and [2.2.1.1]Pagodane dications: frozen two-electron Woodward-Hoffmann transition-state models] (англ.) // Journal of the American Chemical Society. — 1988-11. — Vol. 110, iss. 23. — P. 7764–7772. — ISSN 0002-7863. — doi:10.1021/ja00231a029.
Литература
- Линдберг, Томас (2012-12-02). Стратегии и тактики в органическом синтезе. ISBN 9780323152938.
- Putz, Mihai V .; Мирица, Мариус Константин (2016). "4". Устойчивое развитие наносистем, свойства и применение. IGI Global. п. 124. ISBN 978-1-5225-0493-1.
- Вебер Д.С., Пакетт Л.А. Синтез аминозамещенных додекаэдров, секододекаэдров и гомододекаэдров и их противовирусное отношение к 1-аминоадамантану. J. Org. Химреагент 1988; 53 (22): 5315-5320. doi: 10.1021 / jo00257a021