Герпесвирус, ассоциированный с саркомой Капоши
Герпесвирус, ассоциированный с саркомой Капоши (ГВСК), или вирус герпеса человека 8 типа[3], или герпесвирус человека тип 8[4] (ГВЧ-8, англ. Human gammaherpesvirus 8, ранее Human herpesvirus 8) — вид вирусов из подсемейства гаммагерпесвирусов семейства герпесвирусов. Является одним из восьми известных в настоящее время онковирусов.
| Герпесвирус, ассоциированный с саркомой Капоши | ||||
|---|---|---|---|---|
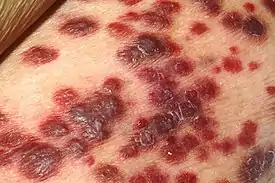 Саркома Капоши | ||||
| Научная классификация | ||||
|
Реалм: Царство: Тип: Peploviricota Класс: Herviviricetes Порядок: Семейство: Подсемейство: Род: Rhadinovirus Вид: Герпесвирус, ассоциированный с саркомой Капоши |
||||
| Международное научное название | ||||
| Human gammaherpesvirus 8 | ||||
| Синонимы | ||||
| Группа по Балтимору | ||||
| I: дцДНК-вирусы | ||||
| ||||
История открытия
В 1872 году Мориц Капоши описал злокачественную опухоль кровеносных сосудов[5] (первоначально она называлась «идиопатическая множественная пигментная саркома кожи»), которая также называется саркомой Капоши. Первоначально считалось, что к саркоме предрасположено еврейское и средиземноморское население, но позднее было установлено, что он широко распространен среди населения стран Африки к югу от Сахары. В 1950-х годах появились первые предположения, что эта опухоль может быть вызвана вирусом. С началом эпидемии СПИДа в начале 1980-х годов произошло внезапное увеличение зарегистрированных случаев саркомы Капоши, поражающая преимущественно больных СПИДом, причем до 50 % зарегистрированных больных СПИДом имели эту опухоль — необычайный уровень предрасположенности к раку. Тщательный анализ эпидемиологических данных, проведенных Валери Берал, Томасом Петерманом и Гарольдом Джаффе[6], привел этих исследователей к предположению, что причиной возникновения опухоли является неизвестный вирус, передающийся половым путем, редко вызывающий опухоли у людей с нормально функционирующей иммунной системой.
Ещё в 1984 году ученые сообщили о том, что наблюдали герпесвирусоподобные структуры в саркомах Капоши, исследованных с помощью электронной микроскопии. Ученые искали агент, вызывающий опухоль, и в качестве возможной причины было предложено более 20 агентов, включая цитомегаловирус и сам ВИЧ. В конце концов, патоген был идентифицирован в 1994 году Юаном Чангом и Патриком С. Муром, командой из его жены и мужа в Колумбийском университете, путем выделения фрагментов ДНК из герпесвируса, обнаруженного в тканях саркомы у больного СПИДом[7][8][9]. Чанг и Мур использовали репрезентативный анализ различий, чтобы найти ГВСК, сравнивая опухолевую ткань больного СПИДом с его собственной неповрежденной тканью. Идея этого эксперимента заключалась в том, что если саркома вызывается вирусом, геномная ДНК в двух образцах должна быть точно идентичной, за исключением ДНК, принадлежащей вирусу. В своем первоначальном эксперименте они выделили два небольших фрагмента ДНК, которые составляли менее 1 % фактического вирусного генома. Эти фрагменты немного отличались от известных геномов герпесвирусов, что указывает на обнаружение нового вируса. Исходя из этих фрагментов, исследовательская группа смогла создать последовательность всего генома вируса менее чем через два года.
Открытие этого герпесвируса вызвало значительные споры, пока не было собрано достаточно данных, доказывающих, что ГВСК действительно является возбудителем саркомы Капоши[10].
Описание
ГВСК представляет собой двуцепочечный ДНК-содержащий вирус. ДНК окружена икосаэдрическим капсидом, состоящим из 162 капсомеров. Снаружи вирус окружает оболочка с гликопротеиновыми шипами. Между капсидом и оболочкой расположен тегумент.
После заражения вирус проникает в лимфоциты, где он остается в латентном состоянии.[4]
Эпидемиология
Серопревалентность (число лиц в популяции с положительной тестом на патоген) ГВСК значительно варьируется географически, уровень заболеваемости в странах Северной Европы, Юго-Восточной Азии и Карибского бассейна составляет от 2 до 4 %[11], в средиземноморских странах — около 10 %, а в странах Африки к югу от Сахары — около 40 %[12]. В Южной Америке уровень заболеваемости в целом низкий, но среди индейцев он выше.[13]. Даже в отдельных странах можно наблюдать значительные различия в разных регионах: уровень распространения инфекции в Синьцзяне составляет около 19,2 %, а в провинции Хубэй — около 9,5 %[14]. Хотя было показано, что серопревалентность постепенно увеличивается с возрастом,[14][15][16][17], страны с высоким уровнем инфицирования могут иметь более высокую серопревалентность и в более молодых возрастных группах[18]. Исследование показало, что уровень образования влияет на заболеваемость[15][16]. Лица, инфицированные ВИЧ-1 или имеющие генитальные бородавки, как правило, с большей вероятностью будут инфицированы ГВСК[12][14][19][20].
В странах с низкой серопревалентностью ГВСК заболевшие — в основном больными СПИДом[21]. В странах с высокой серопревалентностью инфекция часто встречается в детстве[22], что указывает на возможность передачи инфекции от матери к ребёнку[23]. В исследовании в Замбии у всех матерей детей с саркомой Капоши тест на ГВСК был положительным, однако не все дети, чьи матери имели саркому Капоши, имели положительный тест на ГВСК[24]. В другом исследовании в Замбии у 13,8 % детей к 4 годам тест на ГВСК был положительным[20]. Показано, что серопревалентность существенно не изменяется из-за пола или семейного положения[17].
Патология
Болезни, вызываемые герпесвирусом, ассоциированным с саркомой Капоши:
- Саркома Капоши
- Первичная лимфома серозных полостей
- Некоторые разновидности болезни Кастельмана
- Лимфома брюшной полости
Профилактика и диагностика
Поскольку люди, инфицированные ГВСК, как правило, бессимптомно переносят вирус, если они не больны ВИЧ, сексуальный партнер должен проявлять осторожность в отношении незащищённого секса. Для профилактики используется презерватив. Диагностика вируса проводится при анализе крови.
Лечение
Саркома Капоши обычно представляет собой локализованную опухоль, которую можно лечить хирургическим путем или лучевой терапией. Можно использовать химиотерапию такими препаратами, как липосомные антрациклины или паклитаксел, особенно при инвазивных заболеваниях. Противовирусные препараты, такие как ганцикловир, применяются для предотвращения развития саркомы Капоши[25], хотя на последних стадиях опухоли эти препараты практически не используются. Для ВИЧ-инфицированных с саркомой Капоши используется высокоактивная антиретровирусная терапия[26]. У ВИЧ-положительных пациентов, получающих ВААРТ, шанс появления саркомы Капоши снижается вплоть до 10 %.
Примечания
- Таксономия вирусов (англ.) на сайте Международного комитета по таксономии вирусов (ICTV).
- ICTV Taxonomy History for Human gammaherpesvirus 8 на сайте ICTV (англ.) (Дата обращения: 26 июня 2016).
- ГЕРПЕСВИРУСЫ • Большая российская энциклопедия - электронная версия. bigenc.ru. Дата обращения: 16 марта 2020.
- Атлас по медицинской микробиологии, вирусологии и иммунологии : Учебное пособие для студентов медицинских вузов / Под ред. А. А. Воробьева, А. С. Быкова. — М. : Медицинское информационное агентство, 2003. — С. 109. — ISBN 5-89481-136-8.
- Kaposi, M (1872). “Idiopathisches multiples Pigmentsarkom der Haut”. Archiv für Dermatologie und Syphilis. 4 (2): 265—273. DOI:10.1007/BF01830024.
Translated in Kaposi, M (2008). “Idiopathic multiple pigmented sarcoma of the skin”. CA: A Cancer Journal for Clinicians. 32 (6): 342—347. DOI:10.3322/canjclin.32.6.342. - Beral V, Peterman TA, Berkelman RL, Jaffe HW (1990). “Kaposi's sarcoma among persons with AIDS: a sexually transmitted infection?”. Lancet (Submitted manuscript). 335 (8682): 123—8. DOI:10.1016/0140-6736(90)90001-L. PMID 1967430.
- Chang, Y.; Cesarman, E.; Pessin, M. S.; Lee, F.; Culpepper, J.; Knowles, D. M.; Moore, P. S. (1994). “Identification of herpesvirus-like DNA sequences in AIDS-associated Kaposi's sarcoma”. Science. 266 (5192): 1865—1869. Bibcode:1994Sci...266.1865C. DOI:10.1126/science.7997879. PMID 7997879.
- Moore PS, Chang Y (May 1995). “Detection of herpesvirus-like DNA sequences in Kaposi's sarcoma in patients with and without HIV infection”. The New England Journal of Medicine. 332 (18): 1181—5. DOI:10.1056/NEJM199505043321801. PMID 7700310.
- Antman, K.; Chang, Y. (2000). “Kaposi's Sarcoma”. New England Journal of Medicine. 342 (14): 1027—1038. DOI:10.1056/NEJM200004063421407. PMID 10749966.
- Boshoff C, Weiss RA (May 2000). “Addressing Controversies Over Kaposi's Sarcoma”. Journal of the National Cancer Institute. 92 (9): 677—679. DOI:10.1093/jnci/92.9.677. PMID 10793096.
- Zhang, Tiejun; Wang, Linding (2016). “Epidemiology of Kaposi's sarcoma-associated Herpesvirus in Asia: Challenges and Opportunities”. Journal of Medical Virology. 89 (4): 563—570. DOI:10.1002/jmv.24662. ISSN 0146-6615. PMID 27531516.
- Chatlynne, L. G.; Ablashi, D. V. (1999). “Seroepidemiology of Kaposi's sarcoma-associated herpesvirus (KSHV)”. Seminars in Cancer Biology. 9 (3): 175—85. DOI:10.1006/scbi.1998.0089. PMID 10343069.
- Mohanna, S; Maco, V; Bravo, F; Gotuzzo, E (2005). “Epidemiology and clinical characteristics of classic Kaposi's sarcoma, seroprevalence, and variants of human herpesvirus 8 in South America: A critical review of an old disease”. International Journal of Infectious Diseases. 9 (5): 239—50. DOI:10.1016/j.ijid.2005.02.004. PMID 16095940.
- Fu, B; Sun, F; Li, B; Yang, L; Zeng, Y; Sun, X; Xu, F; Rayner, S; Guadalupe, M; Gao, S. J.; Wang, L (2009). “Seroprevalence of Kaposi's sarcoma-associated herpesvirus and risk factors in Xinjiang, China”. Journal of Medical Virology. 81 (8): 1422—31. DOI:10.1002/jmv.21550. PMC 2755560. PMID 19551832.
- Pelser, C; Vitale, F; Whitby, D; Graubard, B. I.; Messina, A; Gafà, L; Brown, E. E.; Anderson, L. A.; Romano, N; Lauria, C; Goedert, J. J. (2009). “Socio-economic and other correlates of Kaposi sarcoma-associated herpesvirus seroprevalence among older adults in Sicily”. Journal of Medical Virology. 81 (11): 1938—44. DOI:10.1002/jmv.21589. PMC 2784645. PMID 19777527.
- Wang, H; Liu, J; Dilimulati; Li, L; Ren, Z; Wen, H; Wang, X (2011). “Seroprevalence and risk factors of Kaposi's sarcoma-associated herpesvirus infection among the general Uygur population from south and north region of Xinjiang, China”. Virology Journal. 8: 539. DOI:10.1186/1743-422X-8-539. PMC 3266657. PMID 22168313.
- Olsen, S. J.; Chang, Y; Moore, P. S.; Biggar, R. J.; Melbye, M (1998). “Increasing Kaposi's sarcoma-associated herpesvirus seroprevalence with age in a highly Kaposi's sarcoma endemic region, Zambia in 1985”. AIDS. 12 (14): 1921—5. DOI:10.1097/00002030-199814000-00024. PMID 9792393.
- Wawer, M. J.; Eng, S. M.; Serwadda, D; Sewankambo, N. K.; Kiwanuka, N; Li, C; Gray, R. H. (2001). “Prevalence of Kaposi sarcoma-associated herpesvirus compared with selected sexually transmitted diseases in adolescents and young adults in rural Rakai District, Uganda”. Sexually Transmitted Diseases. 28 (2): 77—81. DOI:10.1097/00007435-200102000-00003. PMID 11234789.
- Klaskala, W; Brayfield, B. P.; Kankasa, C; Bhat, G; West, J. T.; Mitchell, C. D.; Wood, C (2005). “Epidemiological characteristics of human herpesvirus-8 infection in a large population of antenatal women in Zambia”. Journal of Medical Virology. 75 (1): 93—100. DOI:10.1002/jmv.20242. PMID 15543582.
- Minhas, V; Crabtree, K. L.; Chao, A; m'Soka, T. J.; Kankasa, C; Bulterys, M; Mitchell, C. D.; Wood, C (2008). “Early childhood infection by human herpesvirus 8 in Zambia and the role of human immunodeficiency virus type 1 coinfection in a highly endemic area”. American Journal of Epidemiology. 168 (3): 311—20. DOI:10.1093/aje/kwn125. PMC 2727264. PMID 18515794.
- Kourí, V; Eng, S. M.; Rodríguez, M. E.; Resik, S; Orraca, O; Moore, P. S.; Chang, Y (2004). “Seroprevalence of Kaposi's sarcoma-associated herpesvirus in various populations in Cuba”. Revista Panamericana de Salud Pública. 15 (5): 320—5. DOI:10.1590/s1020-49892004000500006. PMID 15231079.
- Schulz, T. F. (2000). “Kaposi's sarcoma-associated herpesvirus (human herpesvirus 8): Epidemiology and pathogenesis”. The Journal of Antimicrobial Chemotherapy. 45 Suppl T3 (90004): 15—27. DOI:10.1093/jac/45.suppl_4.15. PMID 10855768.
- Brayfield, B. P.; Phiri, S; Kankasa, C; Muyanga, J; Mantina, H; Kwenda, G; West, J. T.; Bhat, G; Marx, D. B.; Klaskala, W; Mitchell, C. D.; Wood, C (2003). “Postnatal human herpesvirus 8 and human immunodeficiency virus type 1 infection in mothers and infants from Zambia”. The Journal of Infectious Diseases. 187 (4): 559—68. DOI:10.1086/367985. PMID 12599072.
- He, J; Bhat, G; Kankasa, C; Chintu, C; Mitchell, C; Duan, W; Wood, C (1998). “Seroprevalence of human herpesvirus 8 among Zambian women of childbearing age without Kaposi's sarcoma (KS) and mother-child pairs with KS”. The Journal of Infectious Diseases. 178 (6): 1787—90. DOI:10.1086/314512. PMID 9815235.
- Martin DF, Kuppermann BD, Wolitz RA, Palestine AG, Li H, Robinson CA (April 1999). “Oral ganciclovir for patients with cytomegalovirus retinitis treated with a ganciclovir implant. Roche Ganciclovir Study Group”. The New England Journal of Medicine. 340 (14): 1063—70. DOI:10.1056/NEJM199904083401402. PMID 10194235.
- Yarchoan, R.; Tosato, G.; Little, R. F. (2005). “Therapy insight: AIDS-related malignancies--the influence of antiviral therapy on pathogenesis and management”. Nature Clinical Practice Oncology. 2 (8): 406—415, quiz 415. DOI:10.1038/ncponc0253. PMID 16130937.