Hsp90
Hsp90 (сокр. от англ. Heat shock protein 90), также белок теплового шока 90 — это белок-шаперон, который помогает другим белкам правильно складываться (участвует в фолдинге), стабилизирует белки от теплового стресса и способствует деградации белка. Он также стабилизирует ряд белков, необходимых для роста опухоли, поэтому ингибиторы Hsp90 исследуются как противораковые лекарственные средства.
| Гистидин киназа-, ДНК-гираза B-, и АТФ-Hsp90 | |
|---|---|
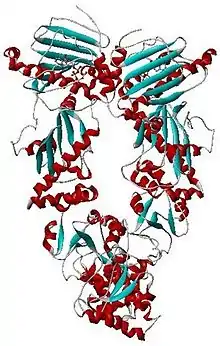 Твёрдая ленточная модель дрожжевого Hsp90-димера (α-спирали = красный, β-листы = голубой, петли = серый) в комплексе с АТФ (красная палочка).[1] | |
| Идентификаторы | |
| Символ | HATPase_c |
| Pfam | PF02518 |
| Pfam clan | CL0025 |
| InterPro | IPR003594 |
| SMART | SM00387 |
| SCOP | 1ei1 |
| SUPERFAMILY | 1ei1 |
| Доступные структуры белков | |
| Pfam | структуры |
| PDB | RCSB PDB; PDBe; PDBj |
| PDBsum | 3D-модель |
| белок Hsp90 | |
|---|---|
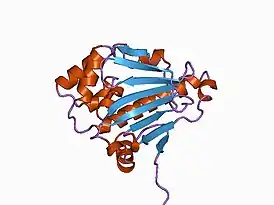 Структура N-концевого домена шаперона дрожжей Hsp90.[2] | |
| Идентификаторы | |
| Символ | Hsp90 |
| Pfam | PF00183 |
| InterPro | IPR020576 |
| PROSITE | PDOC00270 |
| SCOP | 1ah6 |
| SUPERFAMILY | 1ah6 |
| Доступные структуры белков | |
| Pfam | структуры |
| PDB | RCSB PDB; PDBe; PDBj |
| PDBsum | 3D-модель |
Белки теплового шока, как класс, относятся к числу наиболее экспрессивных клеточных белков всех видов[3]. Как следует из их названия, белки теплового шока защищают клетки, когда они подвергаются воздействию повышенных температур. На них приходится 1-2% от общего содержания белка, в не подверженных стрессу клетках. Однако, когда клетки нагреваются, доля белков теплового шока увеличивается до 4-6% от общего содержания клеточных белков[4].
Белок теплового шока 90 (Hsp90) является одним из наиболее распространенных теплосодержащих белков. Название «90» происходит от того, что его молекулярная масса составляет около 90 килодальтон. Белок, имеющий массу 90 кДа считается довольно крупным для нефиброзных белков. Hsp90 встречается у бактерий и всех ветвей эукариот, но, по-видимому, отсутствует в археях[5]. В то время как цитоплазматический Hsp90 необходим для жизнеспособности при всех условиях у эукариот, бактериальный гомолог HtpG может применяться в условиях нетеплового стресса[6].
Изоформы
Hsp90 является высококонсервативным и экспрессируется во множестве различных организмов от бактерий до млекопитающих, включая прокариотический аналог HtpG (высокотемпературный белок G) с 40% идентичностью последовательностей и 55% сходством с белком человека[5]. Hsp90 дрожжей на 60% идентичны Hsp90α человека.
В клетках млекопитающих существуют два или более гена, кодирующих цитозольные гомологи Hsp90[5], с человеческим Hsp90α, имеющим 85% идентичность последовательности с Hsp90β[7]. Предполагается, что α- и β-формы являются результатом события дублирования генов, произошедшего миллионы лет назад[5].
Пять функциональных человеческих генов, кодирующих изоформы белков Hsp90, представлены в виде таблицы[7]:
| семейство | внутриклеточная локализация | подсемейство | ген | семейство |
|---|---|---|---|---|
| HSP90A | цитоплазматический | HSP90AA (индуцируемый) |
HSP90AA1 | Hsp90-α1 |
| HSP90AA2 | Hsp90-α2 | |||
| HSP90AB (конститутивно экспрессируемый) |
HSP90AB1 | Hsp90-β | ||
| HSP90B | эндоплазматический ретикулум | HSP90B1 | Эндоплазмин/ GRP-94 | |
| TRAP | митохондриальный | TRAP1 | белок, ассоциированный с TNF1 |
Существует 12 человеческих псевдогенов (нефункциональных генов), которые кодируют дополнительные изоформы Hsp90, они не экспрессируются в виде белков.
Недавно был идентифицирован связанный с мембраной цитозольный вариант Hsp90, у которого отсутствовал сайт связывания АТФ, и был назван Hsp90N[8]. Этот транскрипт HSP90α-Δ-N представляет собой химеру с первой 105 п.н. кодирующей последовательности, полученной из гена CD47 на хромосоме 3q13.2, и оставшуюся кодирующую последовательность, полученную из HSP90AA1[7]. Однако позже было установлено, что ген, кодирующий Hsp90N не существует в геноме человека. Это, возможно, артефакт клонирования или продукт хромосомной перегруппировки, происходящий в одной клеточной линии[9].
Структура
Общая структура
Общая структура Hsp90 аналогична общей структуре других белков, поскольку она содержит все общие вторичные структурные элементы (например, альфа-спирали, бета-листы и случайные клубки). Будучи цитоплазматическим белком, Hsp90 является глобулярным по структуре, который в основном состоит из остатков неполярных аминокислот внутри и полярных снаружи, данное свойство позволяет взаимодействовать с водой. Hsp90 содержит девять спиралей и восемь антипараллельных бета-листов, которые объединяются, формируя несколько альфа/бета сэндвичных структур. 310 спиралей составляют примерно 11% аминокислотных остатков белка, что намного выше, в среднем на 4%, чем в других белках.
Доменная структура
Hsp90 состоит из четырёх структурных доменов[10][11][12]:
- высококонсервативный N-концевой домен (NTD) ~ 25 кДа
- область так называемого «заряженного линкера», которая соединяет N-конец со средним доменом
- средний домен (MD) ~ 40 кДа
- С-концевой домен (CTD) ~ 12 кДа.
Кристаллические структуры доступны для N-концевого домена дрожжей и Hsp90 человека[13][14][2], для комплексов N-конца с ингибиторами и нуклеотидами и для среднего домена дрожжей Hsp90[13][14][15]. Недавно были выяснены полные длины структур белков Hsp90 из E. coli (2IOP, 2IOQ)[16], дрожжей (2CG9, 2CGE)[17], и эндоплазматического ретикулума собаки (2O1U, 2O1V)[18][19].
Hsp90 образует гомодимеры, где локальные контакты расположены внутри С-конца при открытой конформации димера. N-концы также контактируют в замкнутой конформации димера[15].
N-терминальный домен
N-терминальный домен имеет гомологию не только среди членов семейства шаперонов Hsp90, но также и среди членов суперсемейства АТФазы/GHKL киназы (сокр. от Gyrase, Hsp90, Histidine Kinase, MutL)[11].
Обычный связывающий карман для АТФ и ингибитора гелданамицина расположен в N-концевом домене. Аминокислоты, которые непосредственно участвуют в взаимодействии с АТФ, являются Leu34, Asn37, Asp79, Asn92, Lys98, Gly121 и Phe124. Кроме того, ионы Mg2+ и несколько молекул воды образуют мостиковые взаимодействия, посредством электростатического и водородного связывания, соответственно, между молекулами Hsp90 и AТФ. Кроме того, остаток Glu33 необходим для гидролиза АТФ.
Средний домен
Средний домен разделен на три области:
- 3-слойный α-β-α сэндвич
- 3-оборотная α-спираль и нерегулярные петли
- 6-оборотная α-спираль.
Средний домен (MD) также участвует в связывании с белком клиента. Например, белки, которые, как известно, взаимодействуют с данным MD Hsp90, включают PKB/Akt1, eNOS[20][21], Aha1, Hch1. Кроме того, известно, что связывание субстрата (например, Aha1 и Hch1) с MD также увеличивает активность АТФазы Hsp90[15][22].
C-терминальный домен
С-концевой домен обладает альтернативным сайтом связывания АТФ, который становится доступным, когда занят карман Бержерата N-конца белка[23][24].
На С-терминальном конце белка расположен сайт распознавания мотивов тетратрипептидного повтора (TPR), консервативный пентапептид MEEVD, который отвечает за взаимодействие с кофакторами, такими как иммунофилины FKBP51 и FKBP52, индуцированный стрессом фосфопротеин 1 (Sti1/Hop), циклофилин-40, PP5, Tom70 и многие другие[25].
Выполняемые функции
В нормальных клетках
В клетках, не подверженных стрессу Hsp90 играет ряд важных ролей, которые включают в себя помощь в фолдинге, внутриклеточном переносе, поддержании и деградации белков, а также в облегчении клеточной сигнализации.
Фолдинг белка и роль шаперона
Известно, что Hsp90 ассоциируется с ненативными структурами многих белков, это привело к предложению, что Hsp90 участвует в фолдинге белка вообще. Было показано, что Hsp90 подавляет агрегацию широкого спектра «клиентских» или «субстратных» белков и, следовательно, действует как общий защитный шаперон. Однако Hsp90 несколько более селективный (избирательный), чем другие шапероны.
Деградация белков
Эукариотические белки, которые больше не нужны или неправильно свернуты или повреждены иным образом, обычно маркируются для деструкции (разрушения) путём полиубиквитинирования. Эти убиквитиновые белки распознаются и деструктурируются с помощью 26S протеасом. Следовательно, 26S-протеасомы являются неотъемлемой частью механизма клетки деградации белков. Кроме того, для поддержания третичной структуры протеасомы необходим постоянный источник функционального Hsp90. Наконец, эксперименты с теплочувствительными мутантами Hsp90 и протеасомами 26S предполагают, что Hsp90 ответственен за большинство, если не все, активности АТФазы протеасом.
Взаимодействие со стероидными рецепторами
Глюкокортикоидный рецептор (GR) является наиболее тщательно изученным примером стероидного рецептора, функция которого в решающей степени зависит от взаимодействия с Hsp90[26][27]. В отсутствие кортизола — стероидного гормона, GR находится в цитозоле, в образованном комплексе с несколькими белками-шаперонами, включая Hsp90 (см. Рисунок справа). Эти шапероны поддерживают ГР в состоянии, способном связывать гормон. Вторая роль Hsp90 заключается в связывании иммунофилинов (например, FKBP52), которые присоединяют комплекс GR к пути распространения белка динеина, который транслоцирует (переносит) активированный рецептор из цитоплазмы в клеточное ядро[28]. Один раз в ядре GR димеризуется и связывается с определёнными последовательностями ДНК и тем самым усиливает экспрессию GR-чувствительных генов. Hsp90 также необходим для правильного функционирования ряда других стероидных рецепторов, в том числе ответственных за связывание альдостерона[29], андрогена[30], эстрогена[31] и прогестерона[32].
Опухолевые клетки
Злокачественные клетки сверхэкспрессируют ряд белков, включая рецепторы фактора роста, такие как EGFR или белки трансдукции сигнала, такие как PI3K и AKT (ингибирование данных белков может вызвать апоптоз). Hsp90 стабилизирует различные рецепторы фактора роста и некоторые сигнальные молекулы, включая PI3K и AKT-белки. Следовательно, ингибирование Hsp90 может индуцировать апоптоз посредством ингибирования сигнального пути PI3K/AKT и сигналов фактора роста в целом.
Ещё одна важная роль Hsp90 в канцерогенезе — стабилизация мутантных белков, таких как v-Src, слияния онкогенов Bcr/Abl и мутантных форм p53, которые появляются при трансформации клеток.
Кроме того, Hsp90 участвует во многих ключевых процессах онкогенеза, таких как самодостаточность сигналов роста, стабилизация мутантных белков, ангиогенез и метастазирование.
Примечания
- PDB 2CG9; Ali M.M., Roe S.M., Vaughan C.K., Meyer P., Panaretou B., Piper P.W., Prodromou C., Pearl L.H. Crystal structure of an Hsp90-nucleotide-p23/Sba1 closed chaperone complex (англ.) // Nature : journal. — 2006. — April (vol. 440, no. 7087). — P. 1013—1017. — doi:10.1038/nature04716. — PMID 16625188.
- Prodromou C., Roe S.M., Piper P.W., Pearl L.H. A molecular clamp in the crystal structure of the N-terminal domain of the yeast Hsp90 chaperone (англ.) // Nat. Struct. Biol. : journal. — 1997. — June (vol. 4, no. 6). — P. 477—482. — doi:10.1038/nsb0697-477. — PMID 9187656.
- Csermely P., Schnaider T., Soti C., Prohászka Z., Nardai G. The 90-kDa molecular chaperone family: structure, function, and clinical applications. A comprehensive review (англ.) // Pharmacol. Ther. : journal. — 1998. — August (vol. 79, no. 2). — P. 129—168. — doi:10.1016/S0163-7258(98)00013-8. — PMID 9749880.
- Crevel G., Bates H., Huikeshoven H., Cotterill S. The Drosophila Dpit47 protein is a nuclear Hsp90 co-chaperone that interacts with DNA polymerase alpha (англ.) // Journal of Cell Science : journal. — The Company of Biologists, 2001. — 1 June (vol. 114, no. Pt 11). — P. 2015—2025. — PMID 11493638.
- Chen B., Zhong D., Monteiro A. Comparative genomics and evolution of the HSP90 family of genes across all kingdoms of organisms (англ.) // BMC Genomics : journal. — 2006. — Vol. 7. — P. 156. — doi:10.1186/1471-2164-7-156. — PMID 16780600.
- Thomas J.G., Baneyx F. Roles of the Escherichia coli Small Heat Shock Proteins IbpA and IbpB in Thermal Stress Management: Comparison with ClpA, ClpB, and HtpG In Vivo (англ.) // Journal of Bacteriology : journal. — 1998. — October (vol. 180, no. 19). — P. 5165—5172. — PMID 9748451.
- Chen B., Piel W.H., Gui L., Bruford E., Monteiro A. The HSP90 family of genes in the human genome: insights into their divergence and evolution (англ.) // Genomics : journal. — Academic Press, 2005. — December (vol. 86, no. 6). — P. 627—637. — doi:10.1016/j.ygeno.2005.08.012. — PMID 16269234.
- Grammatikakis N., Vultur A., Ramana C.V., Siganou A., Schweinfest C.W., Watson D.K., Raptis L. The role of Hsp90N, a new member of the Hsp90 family, in signal transduction and neoplastic transformation (англ.) // J. Biol. Chem. : journal. — 2002. — March (vol. 277, no. 10). — P. 8312—8320. — doi:10.1074/jbc.M109200200. — PMID 11751906.
- Zurawska A., Urbanski J., Bieganowski P. Hsp90n - An accidental product of a fortuitous chromosomal translocation rather than a regular Hsp90 family member of human proteome (англ.) // Biochimica et Biophysica Acta : journal. — 2008. — November (vol. 1784, no. 11). — P. 1844—1846. — doi:10.1016/j.bbapap.2008.06.013. — PMID 18638579.
- Pearl L.H., Prodromou C. Structure and in vivo function of Hsp90 (англ.) // Curr. Opin. Struct. Biol.. — 2000. — February (vol. 10, no. 1). — P. 46—51. — doi:10.1016/S0959-440X(99)00047-0. — PMID 10679459.
- Prodromou C., Pearl L.H. Structure and functional relationships of Hsp90 (англ.) // Curr Cancer Drug Targets : journal. — 2003. — October (vol. 3, no. 5). — P. 301—323. — doi:10.2174/1568009033481877. — PMID 14529383.
- Pearl L.H., Prodromou C. Structure, function, and mechanism of the Hsp90 molecular chaperone (англ.) // Adv. Protein Chem. : journal. — 2001. — Vol. 59. Advances in Protein Chemistry. — P. 157—186. — ISBN 978-0-12-034259-4. — doi:10.1016/S0065-3233(01)59005-1. — PMID 11868271.
- Stebbins C.E., Russo A.A., Schneider C., Rosen N., Hartl F.U., Pavletich N.P. Crystal structure of an Hsp90-geldanamycin complex: targeting of a protein chaperone by an antitumor agent (англ.) // Cell : journal. — Cell Press, 1997. — April (vol. 89, no. 2). — P. 239—250. — doi:10.1016/S0092-8674(00)80203-2. — PMID 9108479.
- Prodromou C., Roe S.M., O'Brien R., Ladbury J.E., Piper P.W., Pearl L.H. Identification and structural characterization of the ATP/ADP-binding site in the Hsp90 molecular chaperone (англ.) // Cell : journal. — Cell Press, 1997. — July (vol. 90, no. 1). — P. 65—75. — doi:10.1016/S0092-8674(00)80314-1. — PMID 9230303.
- Meyer P., Prodromou C., Hu B., Vaughan C., Roe S.M., Panaretou B., Piper P.W., Pearl L.H. Structural and functional analysis of the middle segment of hsp90: implications for ATP hydrolysis and client protein and cochaperone interactions (англ.) // Mol. Cell : journal. — 2003. — March (vol. 11, no. 3). — P. 647—658. — doi:10.1016/S1097-2765(03)00065-0. — PMID 12667448.
- Shiau A.K., Harris S.F., Southworth D.R., Agard D.A. Structural Analysis of E. coli hsp90 reveals dramatic nucleotide-dependent conformational rearrangements (англ.) // Cell. — Cell Press, 2006. — October (vol. 127, no. 2). — P. 329—340. — doi:10.1016/j.cell.2006.09.027. — PMID 17055434.
- Ali M.M., Roe S.M., Vaughan C.K., Meyer P., Panaretou B., Piper P.W., Prodromou C., Pearl L.H. Crystal structure of an Hsp90-nucleotide-p23/Sba1 closed chaperone complex (англ.) // Nature : journal. — 2006. — April (vol. 440, no. 7087). — P. 1013—1017. — doi:10.1038/nature04716. — PMID 16625188.
- Dollins D.E., Warren J.J., Immormino R.M., Gewirth D.T. Structures of GRP94-nucleotide complexes reveal mechanistic differences between the hsp90 chaperones (англ.) // Mol. Cell : journal. — 2007. — October (vol. 28, no. 1). — P. 41—56. — doi:10.1016/j.molcel.2007.08.024. — PMID 17936703.
- Wandinger S.K., Richter K., Buchner J. The hsp90 chaperone machinery (англ.) // J. Biol. Chem. : journal. — 2008. — July (vol. 283, no. 27). — P. 18473—18477. — doi:10.1074/jbc.R800007200. — PMID 18442971.
- Sato S, Fujita N, Tsuruo T (September 2000). “Modulation of Akt kinase activity by binding to Hsp90”. Proc. Natl. Acad. Sci. U.S.A. 97 (20): 10832—7. DOI:10.1073/pnas.170276797. PMC 27109. PMID 10995457.
- Fontana J., Fulton D., Chen Y., Fairchild T.A., McCabe T.J., Fujita N., Tsuruo T., Sessa W.C. Domain mapping studies reveal that the M domain of hsp90 serves as a molecular scaffold to regulate Akt-dependent phosphorylation of endothelial nitric oxide synthase and NO release (англ.) // Circ. Res. : journal. — 2002. — May (vol. 90, no. 8). — P. 866—873. — doi:10.1161/01.RES.0000016837.26733.BE. — PMID 11988487.
- Panaretou B., Siligardi G., Meyer P., Maloney A., Sullivan J.K., Singh S., Millson S.H., Clarke P.A., Naaby-Hansen S., Stein R., Cramer R., Mollapour M., Workman P., Piper P.W., Pearl L.H., Prodromou C. Activation of the ATPase activity of hsp90 by the stress-regulated cochaperone aha1 (англ.) // Mol. Cell : journal. — 2002. — December (vol. 10, no. 6). — P. 1307—1318. — doi:10.1016/S1097-2765(02)00785-2. — PMID 12504007.
- Marcu M.G., Chadli A., Bouhouche I., Catelli M., Neckers L.M. The heat shock protein 90 antagonist novobiocin interacts with a previously unrecognized ATP-binding domain in the carboxyl terminus of the chaperone (англ.) // J. Biol. Chem. : journal. — 2000. — November (vol. 275, no. 47). — P. 37181—37186. — doi:10.1074/jbc.M003701200. — PMID 10945979.
- Söti C., Rácz A., Csermely P. A Nucleotide-dependent molecular switch controls ATP binding at the C-terminal domain of Hsp90. N-terminal nucleotide binding unmasks a C-terminal binding pocket (англ.) // J. Biol. Chem. : journal. — 2002. — March (vol. 277, no. 9). — P. 7066—7075. — doi:10.1074/jbc.M105568200. — PMID 11751878.
- Young J.C., Obermann W.M., Hartl F.U. Specific binding of tetratricopeptide repeat proteins to the C-terminal 12-kDa domain of hsp90 (англ.) // J. Biol. Chem. : journal. — 1998. — July (vol. 273, no. 29). — P. 18007—18010. — doi:10.1074/jbc.273.29.18007. — PMID 9660753.
- Pratt W.B., Morishima Y., Murphy M., Harrell M. Chaperoning of glucocorticoid receptors (неопр.) // Handbook of Experimental Pharmacology. — 2006. — Т. 172, № 172. — С. 111—138. — ISBN 3-540-25875-2. — doi:10.1007/3-540-29717-0_5. — PMID 16610357.
- Grad I., Picard D. The glucocorticoid responses are shaped by molecular chaperones (англ.) // Mol. Cell. Endocrinol. : journal. — 2007. — September (vol. 275, no. 1—2). — P. 2—12. — doi:10.1016/j.mce.2007.05.018. — PMID 17628337.
- Pratt W.B., Galigniana M.D., Morishima Y., Murphy P.J. Role of molecular chaperones in steroid receptor action (англ.) // Essays Biochem. : journal. — 2004. — Vol. 40. — P. 41—58. — PMID 15242338. Архивировано 18 августа 2007 года.
- Rafestin-Oblin M.E., Couette B., Radanyi C., Lombes M., Baulieu E.E. Mineralocorticosteroid receptor of the chick intestine. Oligomeric structure and transformation (англ.) // J. Biol. Chem. : journal. — 1989. — June (vol. 264, no. 16). — P. 9304—9309. — PMID 2542305.
- Joab I., Radanyi C., Renoir M., Buchou T., Catelli M.G., Binart N., Mester J., Baulieu E.E. Common non-hormone binding component in non-transformed chick oviduct receptors of four steroid hormones (англ.) // Nature : journal. — 1984. — Vol. 308, no. 5962. — P. 850—853. — doi:10.1038/308850a0. — PMID 6201744.
- Redeuilh G., Moncharmont B., Secco C., Baulieu E.E. Subunit composition of the molybdate-stabilized "8-9 S" nontransformed estradiol receptor purified from calf uterus (англ.) // J. Biol. Chem. : journal. — 1987. — May (vol. 262, no. 15). — P. 6969—6975. — PMID 3584104.
- Catelli M.G., Binart N., Jung-Testas I., Renoir J.M., Baulieu E.E., Feramisco J.R., Welch W.J. The common 90-kd protein component of non-transformed '8S' steroid receptors is a heat-shock protein (англ.) // EMBO J. : journal. — 1985. — December (vol. 4, no. 12). — P. 3131—3135. — PMID 2419124.