Фаговый дисплей
Фаговый дисплей (англ. phage display) — это лабораторный метод изучения белок-белковых, белок-пептидных и ДНК-белковых взаимодействий, использующий бактериофагов для того, чтобы соотнести белки и генетическую информацию, кодирующую их. Суть метода в том, что ген, который кодирует белок, интересующий исследователя, встраивают в ген фага, отвечающий за синтез белка капсида, в результате чего фаг начинает «отображать» исследуемый белок на своей оболочке. Так получают соответствие между генотипом и фенотипом фага, а затем исследуют взаимодействие данного белка с другими белками, пептидами или последовательностями ДНК. С помощью селекции in vitro, аналогичной естественному отбору, и амплификации таким образом могут быть получены большие белковые библиотеки.
Наиболее часто используемыми бактериофагами для фагового дисплея являются M13, T4, T7, филаментные фаги[1] и фаг λ[2].
За использование метода фагового дисплея в отборе пептидов и антител была присуждена Нобелевская премия по химии 2018 г.[3][4][5]
История
Метод фагового дисплея был впервые описан Джорджем Смитом (George P. Smith) в 1985 г.[6], который продемонстрировал «отображение» пептида на филаментном фаге после внесения изменений в ген III этого фага. В том же году получает патент Джордж Печеник (George Pieczenik), который также описывает получение библиотек фагового дисплея. Впоследствии в развитии этой технологии принимали участие группы Лаборатории молекулярной биологии в Кембридже, Исследовательского института Скриппса (США), Национального центра исследования рака (Германия).
Общий вид процедуры
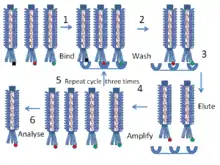
Далее приведены типичные шаги исследования методом фагового дисплея для определения полипептидов, которые связываются с высокой аффинностью с целевыми белками или последовательностями ДНК:
- Целевые белки или последовательности ДНК иммобилизованы (зафиксированы) в ячейках микротитрационного планшета.
- Различные генетические последовательности, вставленные в ген синтеза капсида, экспрессируются в бактериофагах, таким образом, на оболочке каждого фага «отображается» свой белок, соответствующий внесенным генетическим изменениям.
- Эти бактериофаги помещаются на планшет, и спустя некоторое время, которое требуется для связывания, смываются с него.
- Таким образом, на планшете останутся только те фаги, которые хорошо связались с целевыми молекулами, а остальные будут смыты.
- Связавшиеся фаги могут быть элюированы (отмыты) и использованы для получения новых фагов путём заражения подходящих бактерий-носителей. Новая популяция фагов представляет собой смесь, в которой намного меньше нерелевантных (не связывающихся с целевыми молекулами) фагов, чем в изначальной смеси.
- Шаги 3-5 опционально можно повторить несколько раз для получения более богатой специфичными фагами популяции.
- После амплификации с помощью бактерий секвенируется ДНК полученных специфичных фагов для определения белков или их фрагментов, взаимодействующих с целевыми молекулами.
Применения
Применения технологии фагового дисплея включают в себя определение взаимодействующих веществ для определённого белка, позволяя впоследствии установить функцию или механизм работы этого белка. Фаговый дисплей широко используется для белковой эволюции in vitro — так называемой белковой инженерии. В этом применении он является полезным инструментом для поиска и обнаружения новых лекарств. Также он используется для поиска новых лигандов (ингибиторов ферментов, агонистов и антагонистов рецепторов) целевых белков[7][8][9].
С помощью этого метода определяют опухолевые антигены[10] (для целей диагностического и терапевтического таргетирования), а также исследуют ДНК-белковые взаимодействия[11], используя библиотеки специальных последовательностей ДНК с рандомизированными сегментами.
Получение антител in vitro
Изобретение метода фагового дисплея привело к прорыву в области поиска новых антител. В 1991 г. группа Исследовательского центра Скриппса сообщила о первом «отображении» человеческих антител на фаге. Фаговый дисплей библиотек антител стал мощным методом как для изучения иммунного ответа, так и для быстрой селекции и эволюции человеческих антител для последующего использования в терапевтических целях.
Библиотеки антител, отображающие на фагах миллионы различных антител, часто используются в фармацевтической индустрии для выделения узкоспецифичных терапевтических антител с последующей разработкой лекарств, основанных на них, прежде всего противораковых и противовоспалительных.
Примечания
- Kehoe J. W., Kay B. K. Filamentous phage display in the new millennium (англ.) // Chem. Rev. : journal. — 2005. — Vol. 105, no. 11. — P. 4056—4072. — doi:10.1021/cr000261r.
- Smith G. P., Petrenko V. A. Phage display (англ.) // Chem. Rev. : journal. — 1997. — Vol. 97, no. 2. — P. 391—410. — doi:10.1021/cr960065d.
- George P. Smith Nobel Lecture Phage Display: Simple Evolution in a Petri Dish
- Sir Gregory P. Winter Nobel Lecture Harnessing Evolution to Make Medicines
- Кирилл Стасевич. Принудительная эволюция для белков // Наука и жизнь. — 2018. — № 12. — С. 10—15.
- Smith G. P. Filamentous fusion phage: novel expression vectors that display cloned antigens on the virion surface (англ.) // Science : journal. — 1985. — Vol. 228, no. 4705. — P. 1315—1317. — doi:10.1126/science.4001944. — PMID 4001944.
- Lunder M., Bratkovic T., Doljak B., Kreft S., Urleb U., Strukelj B., Plazar N. Comparison of bacterial and phage display peptide libraries in search of target-binding motif (англ.) // Appl. Biochem. Biotechnol. : journal. — 2005. — November (vol. 127, no. 2). — P. 125—131. — doi:10.1385/ABAB:127:2:125. — PMID 16258189.
- Bratkovic T., Lunder M., Popovic T., Kreft S., Turk B., Strukelj B., Urleb U. Affinity selection to papain yields potent peptide inhibitors of cathepsins L, B, H, and K (англ.) // Biochem. Biophys. Res. Commun. : journal. — 2005. — July (vol. 332, no. 3). — P. 897—903. — doi:10.1016/j.bbrc.2005.05.028. — PMID 15913550.
- Lunder M., Bratkovic T., Kreft S., Strukelj B. Peptide inhibitor of pancreatic lipase selected by phage display using different elution strategies (англ.) // J. Lipid Res. : journal. — 2005. — July (vol. 46, no. 7). — P. 1512—1516. — doi:10.1194/jlr.M500048-JLR200. — PMID 15863836.
- Hufton S. E., Moerkerk P. T., Meulemans E. V., de Bruïne A., Arends J. W., Hoogenboom H. R. Phage display of cDNA repertoires: the pVI display system and its applications for the selection of immunogenic ligands (англ.) // J. Immunol. Methods : journal. — 1999. — December (vol. 231, no. 1—2). — P. 39—51. — doi:10.1016/S0022-1759(99)00139-8. — PMID 10648926.
- Gommans W. M., Haisma H. J., Rots M. G. Engineering zinc finger protein transcription factors: the therapeutic relevance of switching endogenous gene expression on or off at command (англ.) // J. Mol. Biol. : journal. — 2005. — December (vol. 354, no. 3). — P. 507—519. — doi:10.1016/j.jmb.2005.06.082. — PMID 16253273.