Тест Эймса
Тест Э́ймса (англ. Ames test) — генетический тест с использованием бактерий Salmonella typhimurium в качестве тест объекта [1]. Предназначен для оценки мутагенного потенциала химических соединений. Положительный результат в тесте показывает, что химическое вещество может обладать канцерогенными свойствами. Так как малигнизация часто связана с повреждением ДНК, тест также используется как экспрессный метод оценки канцерогенного потенциала различных химических соединений, и как дополнение другого аналогичного метода — стандартного теста на грызунах [2]. Методика была описана в ряде работ в начале 1970-х Брюсом Эймсом и его группой в Калифорнийском Университете, Беркли.
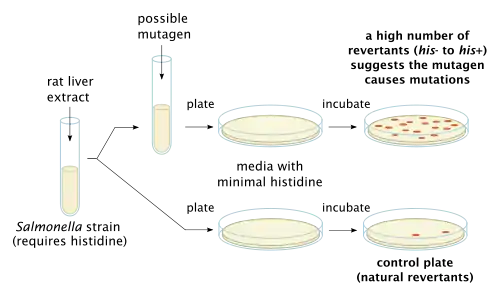
Методика постановки теста
В тесте используются некоторые штаммы бактерии Salmonella typhimurium, которые несут мутации в генах, участвующих в синтезе гистидина (то есть это ауксотрофные мутанты, требующие искусственного внесения гистидина для роста). В тесте изучается возможность предполагаемого мутагена вызывать ревертивную мутацию данного гена, при которой штамм приобретает способность расти на среде, не содержащей гистидин. Предназначенные для тестирования штаммы подобраны таким образом, чтобы содержали обе рамки считывания и точечные мутации в генах ответственных за синтез гистидина, что позволяет обнаруживать мутагены путём воздействия на различные механизмы. Некоторые химические соединения крайне специфичны и поэтому вызывают реверсии только в одном или двух штаммах [3]. Используемые в тесте штаммы также несут мутации в генах, ответственных за синтез липополисахарида, делая клеточные стенки бактерий более проницаемыми,[4]. Кроме того, отсутствие некоторых генов, ответственных за репарационные процессы, делает тест более чувствительным [5]. Ввиду коренных отличий между метаболизмом бактерий и млекопитающих в тесте может быть использована вытяжка из печени крыс для имитации эффекта обмена веществ, так как некоторые соединения, например бенз [а]пирены, не обладают мутагенной активностью, но их производные, которые образуются в процессе метаболизма, приобретают генотоксичность [6].
Бактерии высеваются на агарозную питательную среду в чашки Петри. Среда содержит небольшое количество гистидина. Этого количества гистидина в среде достаточно, чтобы обеспечить жизнедеятельность и рост бактерий в течение некоторого времени и дать возможность успеть за это время мутировать. После исчерпания гистидина, содержавшегося в среде, выживают только ревертантные колонии, которые приобрели способность синтезировать собственный гистидин. Контролем служат бактерии, посеянные на среде, не содержащей исследуемого мутагенного фактора. Инкубация проводится в течение 48 часов. Мутагенный потенциал исследуемого вещества оценивается пропорционально числу обследованных колоний.
Трудности интерпретации результатов
Так как сальмонеллы являются прокариотами, это не идеальная модель для экстраполяции на человека. Первоначальный вариант теста не учитывал метаболиты, которые формируются в печени. В модифицированном варианте теста используется фракция печени S9, которая помогает воссоздать систему более полно и исследовать, способны ли производные исходного вещества давать положительный результат (то есть генотоксичность)[7]. Ряд препаратов, которые содержат нитратные группировки, в действительности не представляющими угрозы здоровью, иногда дают ложно-положительный ответ в тесте Эймса. Нитроглицерин — это пример такого вещества. Он дает положительный результат в тесте Эймса, хотя используется в медицине до сих пор. В тесте Эймса применяются очень высокие концентрации веществ совместно с нитратами, которые способны формировать оксид азота (NO), важную сигнальную молекулу, которая ответственна за ложно-позитивные результаты. Чтобы опровергнуть положительный результат в тесте Эймса необходимы дальнейшие токсикологические исследования. Для преобразования результатов, полученных в тесте Эймса, в интегральный показатель, используется стандартная схема интегральной оценки мутагенного эффекта.
См. также
- Allium test
- Метод доминантных летальных мутаций у Drosophila melanogaster
- Интегральная оценка мутагенного эффекта
Примечания
- Mortelmans K, Zeiger E. The Ames Salmonella/microsome mutagenicity assay // Mutat. Res.. — Elsevier B.V., 200. — № 445 (1-2). — С. 29060.
- Encyclopedia of Public Health. Ames test // Mutat. Res.. — enotes.com, 2002.
- Nishant G. Chapla, E. G. Gurney, James A. Miller, and H. Bartsch. Carcinogens as Frameshift Mutagens: Metabolites and Derivatives of 2-acetylaminofluorene and other Aromatic Amine Carcinogens // PNAS. — 1972. — № 69(11).
- Bruce N. Ames, Frank D. Lee, and William E. Durston. An Improved Bacterial Test System for the Detection and Classification of Mutagens and Carcinogens // PNAS. — 1973. — № 70(3). — С. 782-786.
- Joyce McCann, Neil E. Spingarn, Joan Kobori, and Bruce N. Ames. Detection of Carcinogens as Mutagens: Bacterial Tester Strains with R Factor Plasmids // PNAS. — 1975. — № 72(3). — С. 979-983.
- Bruce N. Ames, William E. Durston, Edith Yamasaki, and Frank D. Lee. Carcinogens are Mutagens: A Simple Test System Combining Liver Homogenates for Activation and Bacteria for Detection // PNAS. — 1973. — № 70. — doi:10.1073/pnas.70.8.2281.
- Zhengyin, Yan, Gary, Caldwell. Optimization in drug discovery: in vitro methods. Chapter "Improvement of the Ames test using human liver S9 preparation". — Methods in pharmacology and toxicology. — Humana Press, 2004.