Пертузумаб
Пертузумаб — лекарственный препарат для лечения рака молочной железы (РМЖ), связанного с амплификацией и гиперэкспрессией гена рецептора HER2 (рецептор эпидермального фактора роста 2 типа). Представляет собой гуманизированное противоопухолевое средство с моноклональными антителами. Применяется при метастатическом раке молочной железы в составе системной терапии и при неметастатическом РМЖ в качестве неоадъювантной (дооперационной) и адъюватной (послеоперационной) терапии. Используется только в комплексе с трастузумабом, который тоже действует на рецептор HER2, и таксанами[2].
| Пертузумаб | |
|---|---|
| Pertuzumab | |
 | |
| Химическое соединение | |
| CAS | 380610-27-5 |
| DrugBank | 06366 |
| Состав | |
| Классификация | |
| АТХ | L01XC13[1] |
| Фармакокинетика | |
| Период полувывед. | 18 дней |
| Лекарственные формы | |
| концентрат для приготовления раствора для инфузий | |
| Способы введения | |
| капельно внутривенно | |
| Другие названия | |
| 2C4, Perjeta, Перьета | |
Разработан в США биотехнологической компании Genentech — дочернее подразделение швейцарской фармкомпании Roche[3]. С 2012 года препарат одобрен Food and Drug Administration (FDA) США для лечения HER2-позитивного РМЖ[4], с 2013-го используется в Европе[5] и России[6][7]. В 2020-м включён Правительством РФ в перечень стратегически значимых лекарств, производство которых должно быть обеспечено на территории страны[8].
История
Эпидемиология
По данным Всемирной организации здравоохранения, в 2020 году рак молочной железы был наиболее часто диагностируемым онкологическим заболеванием у женщин[9], в том числе в России[10]. Эффективность лечения РМЖ можно оценивать по показателю пятилетней выживаемости, этот процент сильно зависит от типа и стадии болезни. Так, для рака молочной железы любого типа на всех стадиях пятилетняя выживаемость составляет около 90 % — это означает, что 90 женщин из 100 благодаря лечению проживут пять лет и больше[11][12].
Порядка 15—20 % случаев РМЖ относится к HER2-положительному типу (связанного с амплификацией и гиперэкспрессией гена рецептора эпидермального фактора роста HER2)[13]. Это одна из самых агрессивных форм РМЖ. Рецептор HER2 находится на поверхности клетки, принимает и передаёт команды к её росту, таким образом он играет решающую роль в сети клеточных сигналов, которые контролируют развитие опухоли[14]. Чрезмерная активность (сверхэкспрессия) HER2 приводит к бесконтрольному росту раковых клеток[15].
Давно изучено, что рецептор HER2 важен для остановки роста опухоли, поэтому исследователи пытаются создать препарат, способный влиять именно на эту клеточную мутацию. К 2021 году медицина располагает серией таргетных препаратов разной эффективности: трастузумаб, TDM1, лапатиниб и пертузумаб[16][17][18].
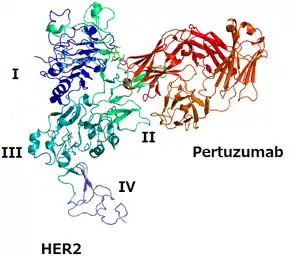
Химическое вещество трастузумаб было одобрено для лечения рака молочной железы ещё в конце 1990-х годов. Вещество взаимодействует с рецептором HER2 и блокирует его активность в IV субдомене (см. иллюстрацию в карточке)[14][18]. У пациентов с РМЖ, получавших трастузумаб в комбинации с химиотерапией, медиана общей выживаемости была выше, чем у пациентов, получавших только химиотерапию[19]. Долгое время трастузумаб был стандартом лечения. Однако, со временем развивается резистентность опухолей, болезнь прогрессирует, поэтому исследователи пытаются улучшить препарат или найти эффективную альтернативу[18].
Разработка пертузумаба
В начале 2010-х швейцарская фармкомпания Roche начала разработку препарата, нацеленного на рецептор HER2. В основу легли приобретённые Genentech (американской «дочкой» Roche) перспективные исследования гуманизированного моноклонального антитела 2C4, влиявшие на раковые клетки in vitro и in vivo[20]. Новое химическое соединение, получившее название пертузумаб, взаимодействует со II доменом рецептора HER2, надёжно связывая его. В результате дальнейших исследований учёные добились ответа HER2-позитивного РМЖ за счёт совместного использования пертузумаба с уже применяющимся препаратом трастузумаб: таким образом создаётся двойная блокада рецептора, что замедляет рост раковых клеток и ведёт к их апоптозу[14].
В журнале The New England Journal of Medicine было опубликовано исследование эффективности пертузумаба в комплексе с существующей терапией[21]. Исследуемая группа получала пертузумаб совместно с трастузумабом и доцетакселом, а контрольной давали плацебо вместо пертузумаба, в остальном схема лечения была такой же. В результате у исследуемой группы отметили значительный рост медианы продолжительности жизни по сравнению с контрольной — 4,7 года против 3,4 соответственно. Это означало задержку развития опухоли примерно на 6 месяцев и снижение риска смерти от РМЖ на 32 %[3][19].
В 2012 году Roche подала на регистрацию препарата в США и Европе[22]. Разрешение на использование выдавались по мере выхода 4 крупных клинических исследований: препарат проверили при метастатическом HER2-положительном РМЖ, изучили эффективность неоадъювантной и адъювантной терапии с использованием пертузумаба[14][18]. FDA одобрил его в качестве терапии первой линии для пациентов с метастатическим HER2-положительным РМЖ в июне 2012 года, EMA — через месяц[3][18]. В том же году Genentech начала выпускать препарат на калифорнийском заводе во Вакавилле под торговым наименованием «Перьета» (в ранних исследованиях препарат назывался Omnitarg[15]).[23] FDA одобрил препарат для использования в составе схемы неоадъювантной терапии в сентябре 2013-го[5][18].
Показания к применению
Препарат всегда применяется в комбинации с трастузумабом и химиотерапией и назначается, когда рак молочной железы ассоциирован с гиперэкспрессией HER2.
- При метастатическом РМЖ пертузумаб является частью системной терапии, задача которой состоит в уменьшении опухолевых очагов и предотвращении прогрессирования заболевания. Его назначают в случаях метастатического или местно-рецидивирующего, неоперабельного рака, если до этого не проводилась HER2-направленная терапия или химиотерапия по поводу метастатического заболевания[2][24];
- При неметастатическом РМЖ пертузумаб применяется в двух случаях: а) в качестве адъювантной (послеоперационной) терапии; б) как неадъювантная (дооперационная) терапия раннего РМЖ, если есть первичная опухоль диаметром более 2 см и/или есть поражение лимфоузлов, задача препарата — уменьшить размеры опухоли вплоть до полного её исчезновения (полный ответ) или остановить её рост[25][26].
Противопоказания
Пертузумаб не рекомендуется к назначению при следующих случаях[25]:
- Гиперчувствительность к действующему веществу и к другим компонентам препарата;
- Проблемы сердечно-сосудистой системы: недавно перенесённый инфаркт миокарда, неконтролируемая артериальная гипертензия, застойная сердечная недостаточность в анамнезе, серьёзные нарушения сердечного ритма, требующие лекарственной терапии на момент назначения препарата, кроме фибрилляции предсердий и пароксизмальной наджелудочковой тахикардии, а также при значениях фракции выброса левого желудочка сердца (ФВЛЖ, минутный объём кровообращения) до лечения < 50 %;
- Предшествующее лечение антрациклином с кумулятивной дозой доксорубицина или эквивалентного препарата > 360 мг/м²;
- Нарушения функции печени (эффективность и безопасность не изучались);
- Беременность и период грудного вскармливания;
- Возраст до 18 лет (эффективность и безопасность не установлены).
С осторожностью препарат назначается в следующих случаях:
- Если снижение ФВЛЖ < 50 % произошло на фоне предшествующей адъювантной терапии трастузумабом или у пациента есть факторы, способные нарушать функцию левого желудочка сердца;
- Если приёму предшествовало лечение антрациклинами, либо была лучевая терапия на область грудной клетки;
- Если нарушена функция почек (исследования не проводились).
Лекарственная форма и способ применения
Пертузумаб выглядит как прозрачная, опалесцирующая или слегка коричневатая жидкость. Выпускается в виде концентрата для приготовления инфузионного раствора. Препарат не содержит антимикробных консервантов, поэтому имеет особые температурные условия хранения и транспортировки[25].
Препарат назначают совместно с трастузумабом (очерёдность введения не важна) и доцетакселом (вводится последним). Раствор пертузумаба вводится капельно внутривенно, первая доза занимает около часа, последующие могут быть сокращены до 30 минут. Введения повторяются каждые 3 недели, продолжительность лечения зависит от типа терапии[15][27]. Рекомендуемая нагрузочная (максимальная) доза — 840 мг, последующие — 420 мг[28]. У препарата существует множество рекомендаций по комбинированию с другими лекарствами[25].
Механизм действия
Пертузумаб относится к таргетной терапии, содержит произведённые искусственным образом антитела, похожие на собственные антитела организма, нацеленные на рецептор HER2[29]. Препарат воздействует на поверхность клетки, прикрепляясь к рецепторам эпидермального фактора роста человека 2-го типа (HER2), блокирует их химические сигналы, замедляя или останавливая бесконтрольный клеточный рост. Одновременно пертузумаб предупреждает иммунную систему, заставляя её атаковать раковые клетки[15][30].
Исследования показывают, что фармакокинетика пертузумаба почти не различается у пациентов с различными видами опухоли, разного пола, этнической принадлежности и возраста (для пациентов младше 18 и старше 65 лет специальные исследования не проводились). Незначительно влияет масса тела пациента, однако у препарата нет рекомендаций корректировать дозу в зависимости от веса[25].
Как и другие антитела, пертузумаб преимущественно подвергается катаболизму, не проходит гематоэнцефалический барьер, а период полувыведения препарата из организма составляет 18 дней[25].
Побочные эффекты
Поскольку пертузумаб назначается в комбинации с трастузумабом и доцетакселом, частота и типы нежелательных реакций могут различаться, а специфические побочные эффекты пертузумаба выявить трудно. Так, наиболее частыми (> 30 %) нежелательными реакциями в исследованиях были диарея, потеря волос и нейтропения (сопутствующие в меньшей степени — снижение аппетита и дисгевзия, бессонница, боль в животе, сыпь). Реакции 2—3 степени тяжести (> 10 %) приходились на нейтропению, фебрильную нейтропению и лейкопению[14][15][18]. Большинство этих реакций были связаны с применение доцетаксела и купировались после его отмены[31].
Наиболее тяжёлой и клинически значимой (<10 %) реакцией было нарушение функции левого желудочка, в том числе симптоматическая систолическая дисфункция левого желудочка (застойная сердечная недостаточность)[14][15][18]. В исследования с пертузумабом включались пациенты с ФВЛЖ > 50 %, что стало отдельным пунктом противопоказаний к препарату. При этом оказалось, что в комплексе трастузумаба с пертузумабом вероятность нарушения функции левого желудочка ниже, чем у терапии только трастузумабом[24][14].
У препарата подробно прописаны возможные нарушения и реакции со стороны различных систем организма. Лечащий врач должен учитывать их перед назначением схемы лечения[15].
Беременность и кормление
Доклинические испытания на животных показали, что пертузумаб может вызвать гибель плода, но не влияет на фертильность. Специальных исследований на эту тему нет, поэтому пациентам, получающим терапию, рекомендуется пользоваться надёжной контрацепцией не менее 6 месяцев после введения последней дозы. Производитель рекомендует не назначать лечение пертузумабом в период беременности[15] и прекратить грудное вскармливание, несмотря на низкую вероятность попадания молекул вещества в молоко[32].
Препарат в России
В России пертузумаб зарегистрирован в Госреестре лекарственных средств под брендом «Перьета» (Perjeta) в марте 2013 года[6][33]. В 2015 году компания Roche зарегистрировала комбинацию пертузумаба с трастузумабом как бренд «Бейодайм». Российская фармкомпания «Биокад» (выпускает аналог трастузумаба) пыталась оспорить эту регистрацию, утверждая, что новый препарат делает Roche фактически монополистом на рынке госзакупок[7]. Однако суд оставил без удовлетворения иск и апелляцию «Биокада»[34].
В 2020-м Roche подала на регистрацию в Минздрав после завершения III фазы клинического исследования фиксированную комбинацию препаратов пертузумаб и трастузумаб с гиалуронидазой под торговой маркой «Фесго» (Phesgo)[35]. Препарат выпускается в едином флаконе и предназначен для подкожного введения в дополнение к внутривенной химиотерапии у пациентов с ранним или метастатическим HER2-положительным раком молочной железы[36][37].
Пертузумаб входит в клинические рекомендации Минздрава России по лечению РМЖ[28]. В августе 2020-го Правительство России добавило пертузумаб в перечень стратегически значимых лекарств, производство которых должно быть обеспечено на территории страны[38][8].
Примечания
- pertuzumab. WHOCC (17 декабря 2020). Дата обращения: 24 сентября 2021.
- PERJETA- pertuzumab injection, solution, concentrate (англ.). DailyMed. U. S. National Library of Medicine.
- Дорогое «удовольствие»: новые лекарства от рака. Медпортал (29 сентября 2014). Дата обращения: 24 сентября 2021.
- New Molecular Entity (NME) Drug and New Biologic Approvals (англ.). FDA (7 апреля 2021). Дата обращения: 24 сентября 2021.
- Anna Edney. Roche Perjeta Wins Panel Backing for Early Breast Cancer (англ.). Bloomberg (12 сентября 2013). Дата обращения: 24 сентября 2021.
- Регистрационное удостоверение Перьета ЛП-002034. Государственный реестр лекарственных средств (22 марта 2013). Дата обращения: 24 сентября 2021.
- «Биокад» проиграл суд Минздраву. Vademec (8 апреля 2016). Дата обращения: 24 сентября 2021.
- новообразования в России в 2019 году7&rangeSize=1 Распоряжение Правительства Российской Федерации от 01.08.2020 № 2015-р. Официальный интернет-портал правовой информации (4 августа 2020). Дата обращения: 24 сентября 2021.
- Breast cancer (англ.). WHO (26 марта 2021). Дата обращения: 21 сентября 2021.
- Злокачественные новообразования в России в 2019 году, 2020.
- Survival Rates for Breast Cancer (англ.). American Cancer Society (27 января 2021). Дата обращения: 21 сентября 2021.
- Triple-negative Breast Cancer (англ.). American Cancer Society (27 января 2021). Дата обращения: 21 сентября 2021.
- Drug Discovery and Development (англ.). Cancer.Net Editorial Board (18 июля 2013). Дата обращения: 21 сентября 2021.
- Kei Ishii, 2019.
- Perjeta (Pertuzumab): Side Effects, How it Works, and More (англ.). Breastcancer (8 июля 2020). Дата обращения: 21 сентября 2021.
- Mark M. Moasser, 2015.
- Харитонова, 2020.
- Marie Robert, 2020.
- Pollack, Andrew. Roche Breast Cancer Drug Perjeta Appears to Greatly Extend Patients’ Lives (англ.), The New York Times (28 September 2014). Дата обращения 17 июня 2021.
- Joan Albanell, 2003.
- Pollack, Andrew. Genentech Wins Approval for New Breast Cancer Drug (англ.), The New York Times (9 June 2012). Дата обращения 17 июня 2021.
- Pollack, Andrew. Two Drugs Appear to Delay Progression of Breast Cancer (англ.), The New York Times (8 December 2011). Дата обращения 17 июня 2021.
- Anna Edney. Roche’s Perjeta for Breast Cancer Wins Approval (англ.). Bloomberg (11 июня 2012). Дата обращения: 24 сентября 2021.
- Harold J Burstein, MD, PhD. Adjuvant systemic therapy for HER2-positive breast cancer (англ.). UpToDate (28 июля 2021). Дата обращения: 24 сентября 2021.
- Roch. Инструкция по медицинскому применению лекарственного препарата Перьета. Минздрав России (5 июля 2021). Дата обращения: 24 сентября 2021.
- FDA grants regular approval to pertuzumab for adjuvant treatment of HER2-positive breast cancer (англ.). FDA (21 декабря 2017). Дата обращения: 24 сентября 2021.
- Sandra M Swain, 2021.
- Клинические рекомендации «Рак молочной железы». Министерство здравоохранения Российской Федерации (2021). Дата обращения: 24 сентября 2021.
- Sue Nichols. Anti-HER2 Therapies for Breast Cancer: How They Work, Side Effects and More (англ.). Breastcancer (5 марта 2021). Дата обращения: 24 сентября 2021.
- NCCN, 2018.
- Sandra M. Swain, Sung-Bae Kim, 2013.
- Pertuzumab // Drugs and Lactation Database (LactMed). — National Library of Medicine (US), 2021-04-19.
- Государственный реестр лекарственных средств 2021 Перьета ЛП-002034. zdravmedinform.ru. Дата обращения: 24 сентября 2021.
- Roche выводит на российский рынок Перьету. Vademec (4 апреля 2017). Дата обращения: 24 сентября 2021.
- Компания «Рош» подала заявку на регистрацию в России комбинированного препарата с подкожным введением для лечения HER2-положительного рака молочной железы. Roche (3 августа 2020). Дата обращения: 24 сентября 2021.
- Breast cancer: New five-minute Phesgo treatment 'great' (англ.), BBC News (6 April 2021). Дата обращения 8 июля 2021.
- Selina McKee. Thousands to benefit from five-minute breast cancer treatment (англ.). PharmaTimes (6 апреля 2021). Дата обращения: 24 сентября 2021.
- Расширен список стратегически значимых препаратов. Vademec (5 августа 2020). Дата обращения: 24 сентября 2021.
Литература
- Mark M. Moasser, Ian E. Krop. The Evolving Landscape of HER2 Targeting in Breast Cancer // JAMA Oncology. — 2015-11-01. — Т. 1, вып. 8. — С. 1154–1161. — ISSN 2374-2437. — doi:10.1001/jamaoncol.2015.2286.
- А. А. Харитонова, И. А. Смирнова, М. В. Киселева. Современные подходы в лечении трижды негативного рака молочной железы // Research'n Practical Medicine Journal. — 2020. — Т. 7, № 1. — С. 55—65. — doi:10.17709/2409-2231-2020-7-1-6.
- Joan Albanell, Jordi Codony, Ana Rovira, Begoña Mellado, Pere Gascón. Mechanism of Action of Anti-HER2 Monoclonal Antibodies: Scientific Update on Trastuzumab and 2C4 (англ.) // New Trends in Cancer for the 21st Century: Proceedings of the International Symposium on Cancer: New Trends in Cancer for the 21st Century, held November 10–13, 2002, in Valencia, Spain / Antonio Llombart-Bosch, Vicente Felipo. — Boston, MA: Springer US, 2003. — P. 253–268. — ISBN 978-1-4615-0081-0. — doi:10.1007/978-1-4615-0081-0_21.
- Sandra M Swain, David Miles, Sung-Bae Kim. Pertuzumab, trastuzumab, and docetaxel for HER2-positive metastatic breast cancer (CLEOPATRA): end-of-study results from a double-blind, randomised, placebo-controlled, phase 3 study (англ.) // The Lancet Oncology. — 2021. — 12 March (vol. 21, no. 4). — P. 519—530. — doi:10.1016/S1470-2045(19)30863-0.
- Sandra M. Swain, Sung-Bae Kim, Javier Cortés. Pertuzumab, trastuzumab, and docetaxel for HER2-positive metastatic breast cancer (CLEOPATRA study): overall survival results from a randomised, double-blind, placebo-controlled, phase 3 study (англ.) // The Lancet Oncology. — 2013. — May (vol. 14, no. 6). — P. 461—471. — doi:10.1016/S1470-2045(13)70130-X.
- National Comprehensive Cancer Network. Рак молочной железы метастатический. — 2018. — 52 с.
- Злокачественные новообразования в России в 2019 году (заболеваемость и смертность) / под ред. А.Д. Каприна, В.В. Старинского, А.О. Шахзадовой. — М.: МНИОИ им. П.А. Герцена − филиал ФГБУ «НМИЦ радиологии» Минздрава России: ФГБУ «НМИЦ радиологии» Минздрава России, 2020. — 252 с. — ISBN 978-5-85502-260-5.
- Kei Ishii, Nao Morii, Hiroyasu Yamashiro. Pertuzumab in the treatment of HER2-positive breast cancer: an evidence-based review of its safety, efficacy, and place in therapy (англ.) // Core Evidence. — 2019. — 31 October (no. 14). — P. 51—70. — doi:10.2147/CE.S217848.
- Marie Robert, Jean-Sébastien Frenel, Emmanuelle Bourbouloux, Dominique Berton Rigaud, Anne Patsouris. Pertuzumab for the treatment of breast cancer // Expert Review of Anticancer Therapy. — 2020. — Т. 20, вып. 2. — С. 85–95. — ISSN 1473-7140. — doi:10.1080/14737140.2019.1596805.