Метод Illumina/Solexa
Метод Illumina/Solexa — метод секвенирования нового поколения, разработанный компанией Solexa.
В основе метода лежит принцип секвенирования путём синтеза[1]:
- Одноцепочечные фрагменты ДНК закрепляются на твердой подложке.
- ДНК-зависимая ДНК полимераза синтезирует комплементарную цепь.
- Встраивание каждого нового нуклеотида регистрируется с помощью камеры.
В методе Solexa используются 3'- модифицированные нуклеотиды с присоединенными флюоресцентными метками разных цветов. Модификация нуклеотидов не позволяет ДНК-полимеразе присоединить больше одного нуклеотида. Флюоресценция инициируется коротким импульсом лазера и тип присоединенного нуклеотида определяется по цвету флюоресцентной метки. Модификация нуклеотида блокируется (полимераза теперь может двигаться дальше) и цикл повторяется снова[2][3]. В результате удается определить последовательность ДНК длиной до 250 нуклеотидов. Такую последовательность ДНК называют прочтением или ридом — (калька с английского).
Первый секвенатор Genome Analyzer 1G был представлен компанией Solexa в 2006 году. Длина прочтения составляла 30-35 нуклеотида, можно было получить около 1 Gb информации. HiSeq 2000 (2011 год) способен секвенировать 6 человеческих геномов за 11 дней. Длина прочтения составляет 100 нуклеотидов, можно получить 600 Gb информации[4].
Принцип метода[5][6]
Подготовка ДНК
(про подготовку РНК смотри ниже — Варианты секвенирования)
- Исследуемая двуцепочечная ДНК фрагментируется.
- К двуцепочечным фрагментам с помощью ДНК-лигазы пришивается небольшой ДНК-фрагмент — адаптер. Адаптер состоит из двух олигонуклеотидов, частично комплементарных друг другу. При смешении таких олигонуклеотидов образуется «вилка», «ножка» которой состоит из двуцепочечной ДНК (там где олигонуклеотиды комплементарны), две «ручки» состоят из одноцепочечной ДНК. Лигаза пришивает два адаптера за «ножку» к каждому концу исследуемого фрагмента ДНК.
- Далее происходит амплификация полученных фрагментов ДНК с помощью ПЦР. В результате образуется множество фрагментов двуцепочечной ДНК, на одном конце — первый олигонуклеотид, составляющий адаптер, на другом конце — второй.
Подготовка ячейки (flowcell)
Ячейка содержит внутри 8 дорожек. В каждой дорожке может секвенироваться отдельный образец.
- На поверхность каждой дорожки пришиваются одноцепочечные олигонуклеотиды. Такие же, что использовались при создании адаптера. Эти олигонуклеотиды в будущем будут связывать исследуемую ДНК (так как они комплементарны адаптеру) и служить праймерами для мостиковой амплификации. В одном из олигонуклеотидов есть сайт для рестриктазы.
Мостиковая амплификация
- Производится плавление исследуемой ДНК и уже одноцепочечные её фрагменты отжигаются на закрепленных на подложке праймерах.
- В систему добавляется все необходимое для ПЦР, кроме праймеров. Праймеры уже есть — это иммобилизованные олигонуклеотиды.
- Полимераза достраивает комплементарную цепь. Теперь каждый исследуемый фрагмент выглядит как двуцепочечная ДНК, конец одной из цепей пришит к поверхности ячейки.
- Проводится плавление двуцепочечной ДНК, в результате которого комплементарные цепи ДНК расходятся. Цепь ДНК, которая не была закреплена на поверхности, удаляется. Каждый исследуемый фрагмент представляет собой одноцепочечную ДНК, пришитую к поверхности ячейки.
- Своим незакрепленным концом цепь ДНК может образовать комплементарное взаимодействие со вторым иммобилизованным олигонуклеотидом. Теперь фрагмент расположен в виде «мостика» — один конец пришит к поверхности, другой держится за счет комплементарных взаимодействий.
- Полимераза снова достраивает комплементарную цепь, используя в качестве праймера второй олигонуклеотид.
- После плавления и удаления незакрепленных цепей ДНК фрагмент выглядит как две одноцепочечные ДНК, прикрепленные к поверхности. Одна цепь расположена «вверх ногами» относительно прикрепленной ДНК в пункте 1. Свободный конец каждой из цепей может образовать мостик с иммобилизованным олигонуклеотидом. Далее повторяются пункты 6 и 7.
- После амплификации, вокруг каждого закрепленного фрагмента появляется большое количество его копий. Половина из копий расположена «вверх ногами». Добавляется рестриктаза, которая расщепляет один из прикрепленных олигонуклеотидов — ненужные копии вымываются. Теперь все копии ДНК, получившиеся в результате амплификации из начального фрагмента, расположены одинаково.
Секвенирование
ДНК-зависимая ДНК полимераза синтезирует комплементарную цепь. Встраивание каждого нового нуклеотида регистрируется с помощью камеры.
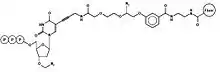
- В систему добавляются праймеры и ДНК-полимераза.
- В систему добавляются 3′-O-азидометил 2′-деоксинуклеозид трифосфаты (A, C, G и T), каждый с отделяемой флюоресцентной меткой своего цвета. Наличие 3′-O-азидометила не позволяет ДНК-полимеразе присоединить больше одного нуклеотида.
- Полимераза присоединяет один модифицированный нуклеотид, оставшиеся нуклеотиды вымываются.
- Ячейка освещается коротким импульсом лазера. Присоединенный флюорофор светится своим цветом. Так как после амплификации вокруг каждой молекулы ДНК есть множество её копий, свет множества одинаковых флюорофоров можно зарегистрировать.
- В систему добавляется вещество (TCEP), из-за которого флюорофор и азидометил отделяются и вымываются. 3′-гидроксильная группа становится доступной для присоединения ещё одного нуклеотида.
- Повторяются пункты 2-5.
Варианты секвенирования
Возможны несколько вариантов секвенирования:
- Секвенирование одиночных прочтений(англ. Single-read sequencing). Данный метод позволяет секвенировать до 8 различных образцов в одной ячейке. За один прогон получается до 100 миллионов прочтений длиной 75 нуклеотидов.
- Секвенирование парных прочтений (англ. Paired-end Sequencing). Позволяет секвенировать два конца длинного фрагмента ДНК; если использовать короткие фрагменты — то будет секвенирована и прямая, и обратная цепь, что повышает точность секвенирования. За один прогон получается до 200 миллионов прочтений длиной 75 пар оснований.
ДНК фрагментируют на участки длиной по 200—500 нуклеотидов. К концам ДНК пришивают два вида адаптеров, так чтобы к разным концам одного фрагмента ДНК были присоединены разные адаптеры. После мостиковой амплификации противоположно ориентированные копии исходного фрагмента не удаляются. В систему добавляется праймер к одному виду адаптера и секвенируется прямую цепь ДНК. Затем добавляется праймер ко второму адаптеру и секвенируют комплементарную цепь. - Множественное (мультиплексное) секвенирование (англ. Multiplex Sequencing). Позволяет одновременно секвенировать до 12 различных образцов на одной дорожке и до 96 образцов в одной ячейке (англ. flowcell). При подготовке ДНК, кроме стандартного адаптера, к образцу пришивается ещё последовательность-индекс. Удобно для одновременного секвенирования небольших геномов.
- Секвенирование спаренных концов (англ. Mate Pair Sequencing). Позволяет секвенировать две последовательности, изначально располагающиеся в геноме на расстоянии до 5000 нуклеотидов друг от друга, как единое целое. Такой подход может быть полезен при de novo секвенировании, при поиске мутаций, для корректной сборки генома.
- Секвенирование РНК. Секвенирование РНК отличается от секвенирования ДНК на стадии подготовки образцов. Если требуется секвенировать только мРНК, то мРНК выделяют по наличию поли-А. Если необходимо секвенировать как мРНК, так и некодирующие РНК, то сначала из клетки выделяют все РНК, а затем рРНК удаляют химическим путём.
РНК фрагментируют на участки по 100—200 нуклеотидов. На матрице РНК, с помощью обратной транскриптазы синтезируют комплементарную цепь ДНК (кДНК). На матрице полученной ДНК синтезируют комплементарную цепь ДНК. Дальше процесс секвенирования РНК совпадает с секвенированием ДНК — лигируют адаптеры, и отжигают на закрепленных на подложке праймерах…
С помощью Illumina/Solexa можно как определять последовательность мРНК, так и анализировать полный транскриптом клетки. С помощью РНК-секвенирования можно изучать альтернативный сплайсинг, аллель-зависимую экспрессию генов или искать новые транскрипты.
Существующие системы
Первый секвенатор выпущенный компанией Illumina был Genome Analyzer 1G. На данный момент существует несколько моделей. Genome Analyzer IIx — самый популярный секвенатор нового поколения. HiScanSQ — совмещает в себе секвенатор и анализатор для работы с микрочипами. HiSeq 2500 и HiSeq 1500 могут запускаться в двух разных режимах: высокопроизводительное секвенирование (много коротких прочтений по 100 нуклеотидов) и быстрое секвенирование (мало длинных прочтений по 150 нуклеотидов).
| HiSeq 2500/2000 | HiSeq 1500/1000 | HiScanSQ | Genome Analyzer IIx | MiSeq | |
|---|---|---|---|---|---|
| Время работы | 11 дней | 8,5 дней | 8,5 дней | 14 дней | 39 часов |
| Длина прочтений | 100 bp | 100 bp | 100 bp | 150 bp | 250 bp |
| Количество прочтений | 6 млрд | 3 млрд | 1,5 млрд | 640 млн | 34 млн |
| Качество секвенирования Q30 | >80 % | >80 % | >80 % | >70 % | >70 % |
Качество секвенирования Q30 означает процент нуклеотидов, для которых вероятность быть ошибочно определенными меньше 0,001.
Преимущества и недостатки метода
По сравнению с другими методами секвенирования нового поколения, метод Illumina наиболее высокопроизводительный — 600 Gb за одно прочтение. Следовательно, стоимость секвенирования на 1 Gb информации будет небольшая. К положительным особенностям можно отнести и точность при небольшой длине прочтения[7][8].
Большинство возникающих ошибок секвенирования — неправильное определение присоединенного нуклеотида. Средняя частота ошибок составляет 0,5 % — одна ошибка на прочтение длиной 200 нуклеотидов[4]. К недостаткам можно отнести высокую стоимость приборов и небольшую длину прочтений (до 250 нуклеотидов).
Примечания
- Carl W Fuller. The challenges of sequencing by synthesis. doi:10.1038/nbt.1585
- Jay Shendure & Hanlee Ji. Next-generation DNA sequencing. doi:10.1038/nbt1486
- Nicole Rusk, Veronique Kiermer. Primer: Sequencing—the next generation. Nature methods, 2008.
- Elaine R. Mardis. Next-Generation Sequencing Platforms. Annu. Rev. Anal. Chem. 2013. 6:287-303
- David R. Bentley et. al. Accurate Whole Human Genome Sequencing using Reversible Terminator Chemistry. Nature. 2008 November 6; 456(7218): 53-59.
- Illumina sequencing technology. 2010. http://www.illumina.com/
- Michael A Quail. A tale of three next generation sequencing platforms: comparison of Ion Torrent, Pacific Biosciences and Illumina MiSeq sequencers. BMC Genomics 2012, 13:341
- Michael L. Metzker. Sequencing technologies — the next generation. 2010. Nature Genetics.