Матрично-активированная лазерная десорбция/ионизация
Матрично-активированная лазерная десорбция/ионизация, МАЛДИ (от англ. MALDI, Matrix Assisted Laser Desorption/Ionization) — десорбционный метод «мягкой» ионизации, обусловленной воздействием импульсами лазерного излучения на матрицу с анализируемым веществом. Матрица представляет собой материал, свойства которого обуславливают понижение деструктивных свойств лазерного излучения и ионизацию анализируемого вещества. МАЛДИ масс-спектрометрия находит своё широкое применение для анализа нелетучих высокомолекулярных соединений (пептиды, белки, углеводы, олигонуклеотиды и др.)
Впервые возможность применения матрицы для подавления фрагментации при анализе нелетучих органических соединений на примере белков и пептидов была продемонстрирована в 1987 году группой ученых в Германии (M. Karas and F. Hillenkamp)[1]. За открытие метода МАЛДИ японский инженер Коити Танака известной японской приборостроительной корпорации Shimadzu получил в 2002 году Нобелевскую премию.
Обычно используется в сочетании с времяпролетным масс-анализатором. Таким образом, верхний рубеж определяемых масс ограничивается пропускаемой способностью анализатора (около 1MDa). Чувствительность метода: << 1 фемтомоль.
Матрица
Количество самых разнообразных органических соединений, использованных в качестве матрицы, очень велико. Правильный выбор материала матрицы является ключевым моментом для успешной регистрации масс-спектра. Поэтому вещество, используемое в качестве матрицы, должно отвечать следующим основным требованиям:
- 1) обладать высоким коэффициентом экстинкции при длине волны лазерного излучения (иными словами, обладать высокой способностью поглощать используемое лазерное излучение);
- 2) иметь способность к ионизации нейтральных молекул анализируемого вещества путём переноса заряда или заряженной частицы;
- 3) обладать хорошей растворимостью в растворителях, применяемых в процессе пробоподготовки;
- 4) быть химически инертным по отношению к анализируемому веществу;
- 5) иметь низкую летучесть в условиях вакуума и термическую устойчивость.
Стоит указать на селективность в выборе матричных соединений по отношению к классу анализируемых соединений. Во многом это определяется различной природой механизмов образования ионов анализируемого вещества. Как правило, доминирующим процессом в их образовании являются процессы вторичной ионизации, а именно ион-молекулярные взаимодействия между матричными ионами и молекулами анализируемого вещества. Иными словами, вторичная ионизация может происходить за счет таких процессов, как перенос протона (Н+), заряженной частицы в виде электрона (e−), металл-катионов (Na+, Ag+ и др.).
Например, существует широко распространенная группа кислотных матриц для анализа белков и пептидов: 2,5-дигидроксибензойная кислота, различные производные коричной (β-фенилакриловой) кислот и т. д. Пептиды и белки, как правило, обладают высокими значениями сродства к протону от 900 кДж/моль и более. Эти значения превышают величины сродства к протону матричных соединений (870–910 кДж/моль), в результате чего реакция переноса протона является экзотермической:
- А + МН+ → М + АН+, где А – молекула анализируемого вещества, М – матричная молекула.
Другой путь образования ионов происходит путём переноса электрона (процесс перезарядки), конечным результатом которого является образование молекулярного радикал-катиона:
- А + М+• → А+• + М.
Это наиболее эффективный способ образования положительных ионов для неполярных соединений с низкими значениями энергии ионизации.
| Название | Английское название (аббревиатура) | Растворители для матрицы | Типы исследуемых веществ |
|---|---|---|---|
| 2,5-Дигидроксибензойная кислота | 2,5-Dihydroxybenzoic Acid(DHB) | Вода, этанол, метанол, ацетон, ацетонитрил, хлороформ, тетрагидрофуран | Пептиды, олигонулеотиды, полисахариды, синтетические полимеры |
| 2-(4-Гидроксифенилазо)-бензойная кислота | 2-(4-Hydroxyphenyazo)-benzoic acid (HABA) | Диоксан, ацетон, тетрагидрофуран, диметилформамид | Пептиды, белки, синтетические полимеры |
| α-циано-4-гидроксикоричная кислота | α-Cyano-4-hydroxycinnamic acid | Ацетон, водн. ацетонитрил, ТГФ, ДМФА, этанол | Пептиды, синтетические полимеры |
| Синапиновая кислота | Sinapic Acid | ТГФ, ДМФА | Пептиды, белки, липиды |
| Феруловая кислота | Ferulic Acid | ТГФ, ДМФА | Пептиды, белки |
| 1,8,9-Антрацентриол | 1,8,9-anthracentriol(Dithranol) | ТГФ, ДМФА, толуол, хлороформ, хлорбензол | Синтетические полимеры, липиды |
Как правило, раствор матрицы в подходящем растворителе (концентрация ~10 мг/мл) готовят ежедневно, поскольку он светочувствителен и подвержен фоторазложению. Наиболее широкое применение в качестве матриц нашли коричная кислота, 3-амино-4-гидроксибензойная кислота, никотиновая кислота, α-циано-4-гидроксикоричная кислота, 2,5-Дигидроксибензойная кислота, 6,7-дигидроксикумарин, 2-(4-Гидроксифенилазо)-бензойная кислота, 3-гидроксипиколиновая кислота, 2,4,6-тригидроксиацетофенон и многие другие. В качестве растворителей чаще всего используют воду, ацетон, этанол, ацетонитрил, хлороформ, тетрагидрофуран и др. Источники МАЛДИ с повышенным давлением позволяют использовать в качестве матрицы воду и ряд других соединений. В этих условиях эффективность работы ИК-лазеров выше, чем УФ-лазеров[2].
Механизм ионизации
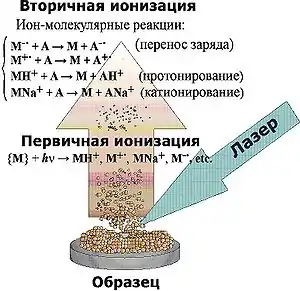
- При облучении лазером с длительностью импульса несколько наносекунд и высокими величинами интенсивности излучения (106 — 107 Вт/см²) из образца, представляющего собой твердый раствор или смесь анализируемого вещества и матрицы, происходит выброс материала в виде микрочастиц. Такие частицы могут достигать размеров несколько сотен микрометров. Над поверхностью образца возникает область высокого локального давления — так называемый факел (от англ. англ. plume — факел, шлейф, султан), который преимущественно состоит из нейтральных частиц. Вместе с тем, в нем присутствуют и заряженные частицы, доля которых по разным оценкам составляет 10−5—10−3 от полного числа всех частиц. На начальном этапе образования факела его плотность близка к плотности вещества в конденсированном состоянии.
- C расширением факела (в первые наносекунды) происходит распад конгломератов вплоть до образования отдельных молекул или их фрагментов, а также заряженных (преимущественно матричных) частиц. Ионизацию молекул, происходящую непосредственно при выбросе материала из конденсированного состояния, принято рассматривать как первичную.
- В расширяющемся факеле происходят непрерывные соударения между частицами, в том числе возможны ион-молекулярные реакции между матричными заряженными частицами и молекулами анализируемого вещества, которые приводят к ионизации последнего. Такого рода ионизацию относят к вторичной.
Применение
К настоящему времени методом МАЛДИ успешно анализируют самые разнообразные классы веществ:
- Биоорганические соединения (полипептиды, белки, олигонуклеотиды, олиго- и полисахариды и т. п.);
- синтетические полимеры;
- органические комплексные соединения;
- высокомолекулярные материалы;
- гуминовые кислоты;
- синтетические дендримеры;
- фуллерены и др.
Метод МАЛДИ используют прежде всего для установления молярной массы соединения.
МАЛДИ масс-спектрометрия в медицине
С конца 2000-х технология MALDI-TOF начала применяться в практической медицине для быстрой идентификации видовой принадлежности [3]. В 2009 году компания Bruker представила первую в мире клиническую версию системы MALDI Biotyper. Идентификация микроорганизмов основывалась на получения общего масс-спектра белков в диапазоне 1000-10000 дальтон и биоинформационного сравнения полученного спектра с базой данных рефренсных спектров. Применение метода позволило значительно сократить затраты и время бактериологического анализа и увеличить его точность.
См. также
Ссылки
- Karas M., Bachmann D., Bahr D. and Hillenkamp F. “Matrix-assisted ultraviolet-laser desorption of nonvolatile compounds” // Int. J. Mass Spectrom. Ion Proc.. — 1987. — № 78. — С. 53—68.
- Hillenkamp F., Berkenkamp S., Leisner A. How Cool is MALDI? An Introduction to High Pressure MALDI Sources // Ext. Abstr. 50th Proceedings of the ASMS Conference on Mass Spectrometry & Allied Topics. Orlando, Forida, USA, June 2-6, 2002, A020361.
- Mellmann A, Cloud J, Maier T, Keckevoet U, Ramminger I, Iwen P, Dunn J, Hall G, Wilson D, Lasala P, Kostrzewa M, Harmsen D. Evaluation of Matrix-Assisted Laser Desorption Ionization-Time-of-Flight Mass Spectrometry in Comparison to 16S rRNA Gene Sequencing for Species Identification of Nonfermenting Bacteria // J Clin Microbiol. — 2008. — № Jun;46(6). — С. 1946—1954.