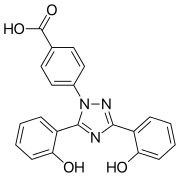
Деферазирокс
Деферазирокс (позиционируется как Эксиджад,[1] Desirox, Defrijet, Desifer, Rasiroxpine и Jadenu) оральный хелатор. Его основное назначение заключается в снижении хронической перегрузки железом у пациентов, длительно получающих переливание крови для условий, таких как бета-талассемии и других хронических анемий.[2][3] Это первый Оральный препарат одобрен в США для этой цели.[4]
| Деферазирокс | |
|---|---|
 | |
 | |
| Химическое соединение | |
| ИЮПАК |
4-[(3Z,5E)-3,5-бис(6-оксо-1-циклогекса-2,4- диенилиден)-1,2,4-триазолидин-1-ил]бензойная кислота |
| Брутто-формула | C21H15N3O4 |
| Молярная масса | 373.362 г/моль |
| CAS | 201530-41-8 |
| PubChem | 5493381 |
| DrugBank | DB01609 |
| Состав | |
| Классификация | |
| АТХ | V03AC03 |
| Фармакокинетика | |
| Биодоступн. | 70% |
| Связывание с белками плазмы | 99% |
| Метаболизм | Hepatic glucuronidation |
| Период полувывед. | 8 to 16 hours |
| Экскреция | Fecal (84%) and renal (8%) |
| Способы введения | |
| Oral | |
Он был одобрен комитетом продовольствия и медикаментов (FDA) в ноябре 2005 года.[2][4] По данным FDA (Май 2007 года), почечная недостаточность и цитопений были зарегистрированы у больных, получающих деферазирокс таблетки пероральной суспензии. Он одобрен в ЕС европейским Агентством по лекарственным средствам (ЕМА) для детей от 6 лет и старше для хронической перегрузки железом от повторных переливаний крови.[5][6][7]
Свойства деферазирокса
_complex.png.webp)
Период полураспада деферазирокса находится в интервале между 8 и 16 часами. Две молекулы деферазирокса способны связывать 1 атом железа, которая впоследствии устраняется путём фекальной экскреции. Его низкий молекулярный вес и высокая липофильность позволяет препарат приём внутрь, в отличие от дефероксамин , который должен быть введён внутривенно (внутривенная инфузия). Вместе с деферипроном, деферазирокс, способен извлекать железо из клеток (кардиомиоцитов и гепатоцитов), а также для удаления железа из крови.
Синтез
Деферазирокс можно синтезировать из простых имеющихся в продаже исходных веществ (салициловая кислота, салициламид и 4-гидразинбензойная кислота) в следующем двухстадийном синтезе:
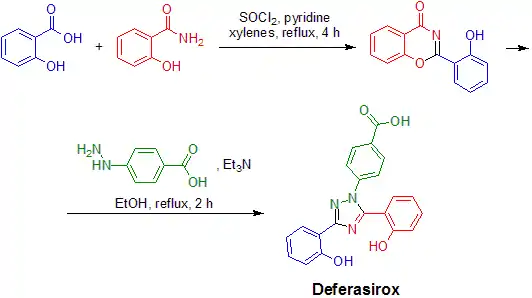
Конденсация салицилоилхлорида (образуется in situ при взаимодействии салициловой кислоты и тионилхлорида) с салициламидом в условиях дегидратации приводит к образованию 2-(2-гидроксифенил)-1,3(4H)-бензоксазин-4-она. Этот промежуточный продукт выделяют и подвергают взаимодействию с 4-гидразинбензойной кислотой в присутствии основания, получая 4-(3,5-бис(2-гидроксифенил)-1,2,4-триазол-1-ил)бензойную кислоту (Деферазирокс).[8]
Риски
Деферазирокс был вторым препаратом в списке наиболее частых смертей пациента, составляемом Институтом безопасной медицинской практики в 2009 году. [9]
Ссылки
- Official manufacturer website including information for health care professionals about indications, dosing, safety and more: http://www.exjade.com/
- Current status of iron overload and chelation with deferasirox (англ.) // Indian J Pediatr : journal. — 2007. — Vol. 74, no. 8. — P. 759—764. — doi:10.1007/s12098-007-0134-7. — PMID 17785900.
- Deferasirox : a review of its use in the management of transfusional chronic iron overload (англ.) // Drugs : journal. — 2007. — Vol. 67, no. 15. — P. 2211—2230. — doi:10.2165/00003495-200767150-00007. — PMID 17927285.
- United States Food and Drug Administration (November 9, 2005). FDA Approves First Oral Drug for Chronic Iron Overload. Пресс-релиз. Проверено 2007-10-31.
- Exjade - deferasirox, from EMA website
- Turning a blind eye to deferasirox's toxicity?
- Review: Exjade side effects
- Stefan Steinhauser; Stefan Steinhauser. Complex Formation of ICL670 and Related Ligands with FeIII and FeII (англ.) // European Journal of Inorganic Chemistry : journal. — 2004. — Vol. 2004, no. 21. — P. 4177—4192. — doi:10.1002/ejic.200400363.
- ISMP. ISMP QuarterWatch(TM), ISMP Medication Safety Alert, С. 1–3.