Абакавир/Долутегравир/Ламивудин
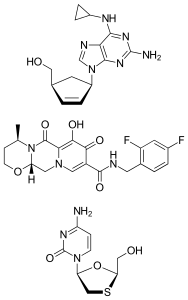
Абакавир/Долутегравир/Ламивудин (торговая марка Triumeq) — это комбинированный антиретровирусный препарат с фиксированной дозой для лечения ВИЧ/СПИДа. Это комбинация трёх препаратов с различными и взаимодополняющими механизмами действия: 600 мг абакавира (ингибитор обратной транскриптазы), 50 мг долутегравира (ингибитор интегразы) и 300 мг ламивудина (ингибитор обратной транскриптазы нуклеозидного аналога).
| Абакавир/Долутегравир/Ламивудин | |
|---|---|
 | |
| Химическое соединение | |
| Брутто-формула | C42H48F2N12O9S |
| CAS | 1319715-09-7 |
| PubChem | 54736666 |
| Состав | |
|
|
| Классификация | |
| АТХ | J05AR13 |
| Способы введения | |
| Перорально | |
| Другие названия | |
| Triumeq | |
Лекарство было разработано ViiV Healthcare и было одобрено для использования в США и Европейском Союзе в 2014 году[1][2][3].
Абакавир — нуклеотидный ингибитор обратной транскриптазы. В частности, абакавир представляет собой аналог гуанозина, который препятствует работе вирусной РНК-зависимой ДНК-полимеразы ВИЧ, что в конечном итоге приводит к ингибированию репликации ВИЧ. Долутегравир ингибирует цикл репликации ВИЧ, связываясь с активным центром интегразы и ингибируя этап переноса цепи интеграции ДНК ВИЧ-1. Ламивудин — аналог цитозина, который ингибирует обратную транскрипцию ВИЧ, обрывая цепь вирусной ДНК[4].
Исследования
Клинические испытания
Эффективность абакавира/долутегравира/ламивудина была продемонстрирована у пациентов, ранее не получавших антиретровирусную терапию, с помощью SINGLE (ING114467), рандомизированном контролируемом исследовании и других исследованиях на пациентах, ранее не получавших антиретровирусную терапию (см. Тивикай, Долутегравир).
В исследовании SINGLE, 414 пациентов получали тивикай (долутегравир) + эпзиком (абакавир/ламивудин) один раз в сутки и 419 пациентов получали атриплу (эфавиренз/эмтрицитабин/тенофовир) один раз в сутки. Tivicay + Epzicom по сравнению с Atripla показал снижение вирусной нагрузки РНК ВИЧ-1 <50 копий / мл у 80 % пациентов по сравнению с 72 % пациентов, соответственно. Кроме того, у пациентов с исходной вирусной нагрузкой в плазме <100000 и >100000 копий / мл Tivicay + Epzicom по сравнению с Atripla показал снижение до <50 копий / мл у 85 % и 71 % по сравнению с 73 % и 72 % соответственно[5].
Постмаркетинговый опыт
В дополнение к побочным реакциям, о которых сообщалось в клинических испытаниях, следующие побочные реакции были зарегистрированы добровольно от популяции неизвестного размера. Таким образом, не всегда возможно оценить частоту или установить причинно-следственную связь с воздействием наркотиков[6].
Абакавир и / или Ламивудин
- Пищеварительная система: стоматит
- Желудочно-кишечный тракт: панкреатит
- Общее: астения
- Кровеносная и лимфатическая системы: апластическая анемия, анемия, лимфаденопатия, спленомегалия
- Гиперчувствительность: реакции сенсибилизации (в том числе анафилаксия), крапивница
- Нарушения обмена веществ и питания: гиперпролактинемия
- Скелетно-мышечная система: мышечная слабость, повышение КФК, рабдомиолиз
- Нервная система: парестезия, периферическая невропатия, эпилептический приступ
- Дыхательная система: ненормальные звуки дыхания / хрипы
- Кожа: выпадение волос, многоформная эритема. Сообщалось о подозрении на синдром Стивенса — Джонсона (SJS) и токсический эпидермальный некролиз (TEN) у пациентов, получавших абакавир в основном в комбинации с лекарствами, которые, как известно, связаны с SJS и TEN, соответственно.
Побочные эффекты
Следующие побочные реакции были зарегистрированы у <2 % пациентов[4]:
- Центральная нервная система: сонливость, летаргия, кошмары, нарушения сна, суицидальные мысли
- Дерматологические: зуд
- Эндокринная система и метаболизм: высокий уровень триглицеридов
- Желудочно-кишечный тракт: вздутие живота, расстройство живота, боль в животе, отсутствие аппетита, расстройство желудка, метеоризм, гастроэзофагеальная рефлюксная болезнь, боль в верхней части живота, рвота
- Печёночный: гепатит
- Нервно-мышечные и скелетные: боли в суставах, воспаление мышц
- Почки: хроническая болезнь почек
- Разное: лихорадка
Беременность
Абакавир/долутегравир/ламивудин относится к категории C при беременности, поскольку адекватных и хорошо контролируемых исследований у беременных женщин не проводилось. Однако исследования репродукции с компонентами Triumeq были выполнены на животных. Triumeq следует использовать во время беременности, только если потенциальные преимущества перевешивают риски. Для мониторинга материнско-плодных исходов беременных женщин, которые принимали антиретровирусные препараты, включая Triumeq, был создан Реестр антиретровирусных беременных[7].
Грудное вскармливание
Центры по контролю и профилактике заболеваний США (CDC) рекомендуют ВИЧ-инфицированным матерям не кормить грудью своих младенцев, чтобы избежать риска послеродовой передачи ВИЧ. Эта рекомендация сочетается с возможностью серьёзных побочных реакций у грудных детей. Было показано, что долутегравир и абакавир выделяются с молоком кормящих крыс. Было показано, что ламивудин выделяется с грудным молоком человека.
История
Одобрение
Патент был подан 28 апреля 2006 года[8] (её срок истекает 5 октября 2027 г.)[9]. Был одобрен для использования в США и Европейском Союзе в 2014 году[1][2].
Основные изменения этикетки
В августе 2015 года Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) разослало бюллетень об обновлениях этикеток для Tivicay и Triumeq, касающихся информации о лекарствах[6].
Взаимодействие с лекарственными средствами было обновлено, чтобы включить заявление о том, что in vitro долутегравир не является субстратом OATP1B1 или OATP1B3. А также, информация о лекарственных взаимодействиях с карбамазепином и метформином[6].
Кроме того, были обновлены данные о менее распространённых побочных реакциях, наблюдаемых в клинических испытаниях, чтобы включать суицидальные мысли, попытки, поведение или завершение, чтобы соответствовать этикетке Tivicay[10].
В сентябре 2015 года FDA добавило предупреждение о реакциях гиперчувствительности, лактоацидозе и тяжёлой гепатомегалии в препаратах, содержащих абакавир, в отношении аллеля HLA-B * 507[11]. Предупреждение в штучной упаковке (9/2015)
- Реакции гиперчувствительности
- Лактоацидоз и тяжёлая гепатомегалия со стеатозом
- Обострения гепатита В
Дозировка и администрирование
- Рекомендации по дозировке некоторых сопутствующих лекарств (8/2015)
- Не рекомендуется из-за отсутствия корректировки дозировки (9/2015)
Противопоказания (9/2015) Предупреждения и меры предосторожности, реакции гиперчувствительности (9/2015)
Общество и культура
Утилизация
ViiV Healthcare — это конгломерат независимой фармацевтической компании, основанной GlaxoSmithKline и Pfizer в 2009 году с исключительным вниманием к лечению и уходу в связи с ВИЧ. В 2012 году компания Shionogi присоединилась к компании после длительного сотрудничества по совместной разработке нескольких новых ингибиторов интегразы. В 2014 году 12 текущих препаратов ViiV Healthcare от ВИЧ принесли годовой объём продаж около $2,3 миллиарда[12][13]. В 2014 году продажи GlaxoSmithKline выросли на 15 % после запуска Tivicay и Triumeq (совокупные продажи составили 510 миллионов долларов)[14].
Другие лекарства, запатентованные ViiV Healthcare для лечения ВИЧ, включают:
- Тивикай (Долутегравир)
- Целзентри (Маравирок)
- Kivexa (Абакавир/Ламивудин)
- Зиаген (Абакавир)
- Trizivir (Абакавир/Ламивудин/Зидовудин)
- Combivir (Ламивудин/Зидовудин)
- Epivir/3TC (Ламивудин)
- Retrovir/AZT (Зидовудин)
- Lexiva/Telzir (Фосампренавир)
- Viracept (Нельфинавир)
- Rescriptor (Делавирдин)
Стоимость
Годовая поставка абакавира/долутегравира/ламивудина стоит около $33 000, поскольку он запатентован и недоступен в качестве дженерика[4].
В июле 2015 года ViiV Healthcare заключила сделку с находящейся в Шанхае Desano Pharmaceuticals на более дешёвую поставку долутегравира (Tivicay) с целью снижения стоимости в Китае и других развивающихся странах. После утверждения Tivicay в 2014 году его розничная стоимость в США составила $14 000 в год[15].
См. также
Примечания
- "Triumeq (abacavir sulfate, dolutegravir, and lamivudine), Fixed-Dose Combination Tablets". U.S. Food and Drug Administration (FDA) (2014). Дата обращения: 21 июня 2021.
- "Triumeq EPAR". European Medicines Agency (EMA) (2014). Дата обращения: 21 июня 2021.
- "FDA Approves Triumeq". drugs.com (August 22, 2014). Дата обращения: 21 июня 2021.
- "Triumeq". rxlist.com (2021). Дата обращения: 21 июня 2021.
- A Trial Comparing GSK1349572 50mg Plus Abacavir/Lamivudine Once Daily to Atripla (Also Called The SINGLE Trial). ClinicalTrials.gov (2010). Дата обращения: 21 июня 2021.
- Davy James. FDA Updates Labels of Two HIV Drugs. pharmacytimes.com (August 6, 2015). Дата обращения: 21 июня 2021.
- "FDA: Potential Risk of Neural Tube Birth Defects". U.S. Food and Drug Administration (FDA) (May 18, 2018). Дата обращения: 21 июня 2021.
- Substituted 5-hydroxy-3,4,6,9,9a, 10-hexanhydro-2h-1-oxa04a,8a-diaza-anthracene-6,10-dioness. United States Patent (March 6, 2012). Дата обращения: 21 июня 2021.
- "Orange Book: Approved Drug Products with Therapeutic Equivalence Evaluations". U.S. Food and Drug Administration (FDA) (2020). Дата обращения: 21 июня 2021.
- "Tivicay (dolutegravir) and Triumeq (abacavir/dolutegravir/lamivudine) product labeling was updated". govdelivery.com (08.05.2015). Дата обращения: 21 июня 2021.
- "Safety Information - Ziagen (abacavir sulfate) Tablets and Oral Solution". fda.gov (September 2015). Дата обращения: 21 июня 2021.
- "Who we are - ViiV Healthcare". www.viivhealthcare.com (2015). Дата обращения: 21 июня 2021.
- Luke MacGregor. "GSK to buy HIV drugs from Bristol-Myers Squibb for initial $350 million". Reuters (December 18, 2015). Дата обращения: 21 июня 2021.
- "Annual Report 2014 - GSK". www.gsk.com (2014). Дата обращения: 21 июня 2021.
- "ViiV Healthcare and Desano Pharmaceuticals' manufacturing agreement will allow competitive supply of dolutegravir in China and several developing countries". viivhealthcare.com (July 2, 2015). Дата обращения: 21 июня 2021.